Постулаты Бора. Элементарная боровская теория водородного атома.
Выход из противоречия, возникшего между законами классической физики и выводами, вытекающими из результатов опытов Резерфорда, предложил Нильс Бор, который в 1913 году сформулировал следующие постулаты[1]: 1) Из бесконечного множества электронных орбит, возможных для электрона в атоме с точки зрения классической механики, на самом деле реализуются лишь некоторые, называемые стационарными. Находясь на стационарной орбите электрон не излучает энергию (э/м волны) хотя и движется с ускорением. Для стационарной орбиты момент импульса электрона должен быть целым кратным от постоянной величины me∙v r = nħ, (1) где me – масса электрона, v –скорость электрона, r – радиус электронной орбиты, n – целое число, которое может принимать значения 1, 2, 3, 4…и называется главным квантовым числом. 2) Излучение испускается или поглощается атомом в виде светового кванта энергии
hν = ħ∙ω = En2 - En1 (2)
Такое же соотношение справедливо и для случая поглощения. Соотношение (2) называется правилом частот Бора.
|


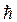 – постоянная Дирака). Т.е. должно выполняться соотношение:
– постоянная Дирака). Т.е. должно выполняться соотношение: при переходе электрона из одного стационарного (устойчивого) состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний E n1 и E n2 , между которыми совершается квантовый скачок электрона:
при переходе электрона из одного стационарного (устойчивого) состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний E n1 и E n2 , между которыми совершается квантовый скачок электрона:


