Концентрация растворов
Концентрацией раствора называется количество растворенного вещества, содержащееся в определенном количестве или в определенном объеме раствора или растворителя. В химии наиболее употребимы следующие способы выражения концентрации. Процентная концентрация. Показывает число граммов растворенного вещества, содержащихся в 100 г раствора. Например, 15%-ный водный раствор соли – это такой раствор, в 100 г которого содержится 15 г соли и 85 г воды. Молярная концентрация (молярность). Показывает число молей растворенного вещества, содержащихся в 1 л раствора, обозначается моль/л или формулой вещества, заключенной в квадратные скобки. Например, [NaOH]=2 моль/л – это раствор, содержащий 2 моля (или 80 г) гидроксида натрия в одном литре раствора. Молярная концентрация эквивалентов. Показывает число молей эквивалентов растворенного вещества, содержащихся в 1 л раствора, обозначается С эк. Например, С эк H2SO4=0,1моль экв/л – это раствор Н2SO4 , содержащий 0,1 моля эквивалентов серной кислоты (или 4,9 г) в 1 л раствора. Эквивалентом (обозначается буквой Э) называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Эквивалент кислоты равен молярной массе кислоты, деленной на ее основность, т.е. на число атомов водорода в молекуле кислоты, способных замещаться на металл. Эквивалент основания равен молярной массе основания, деленной на валентность металла. Эквивалент оксида равен молярной массе оксида, деленной на произведение числа атомов элемента, входящих в состав молекулы, и валентности этого элемента. Эквивалент соли равен молярной массе соли, деленной на произведение валентности металла и числа атомов металла в ее молекуле. Например: моль экв. Н2SO4 (М=98 г/моль) равен моль экв. Са(ОН)2 (М=74 г/моль) равен моль экв. Al2O3 (М=102 г/моль) равен моль экв. Al2(SO4)3 (М=342 г/моль) равен Растворы с молярной концентрацией эквивалентов широко применяются при проведении реакций между растворенными веществами. Пользуясь этой концентрацией, легко заранее рассчитать, в каких объемных соотношениях должны быть смешаны растворенные вещества, для того чтобы они прореагировали без остатка. Согласно закону эквивалентов количества веществ, вступающих в реакцию, пропорциональны их эквивалентам:
Следовательно, для реакции всегда нужно брать такие объемы растворов, которые содержали бы одинаковое число молей эквивалентов растворенных веществ. При одинаковой молярной концентрации растворов объемы реагирующих веществ пропорциональны их С эк. Если объемы затрачиваемых на реакцию растворов обозначить через V 1 и V 2 , а их молярные концентрации эквивалентов через С эк.1 и С эк.2, то зависимость между этими величинами выразится отношением:
т.е. объемы реагирующих веществ обратно пропорциональны молярным концентрациям их эквивалентов. На основании этих зависимостей можно не только вычислить необходимые для проведения реакций объемы растворов, но и по объемам затраченных на реакцию растворов находить их концентрации. Титр. Показывает количество граммов растворенного вещества, содержащееся в 1 мл раствора. Обозначается буквой Т. Зная титр раствора, легко вычислить его молярную концентрацию эквивалента, и наоборот:
Моляльная концентрация (моляльность). Показывает число молей растворенного вещества, содержащееся в 1000 г растворителя, обозначается С m:
где m – количество растворенного вещества,
|





 .
.
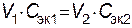 ,
,


 ,
,
 (5.3)
(5.3)
 – количество растворителя, г; M – мольная масса растворенного вещества, г/моль.
– количество растворителя, г; M – мольная масса растворенного вещества, г/моль.


