Химическое равновесие. 4.14.1. Состояние равновесия
4.14.1. Состояние равновесия Реакции, протекающие при одних и тех же условиях одновременно в противоположных направлениях, называютсяобратимыми. Рассмотрим простую обратимую реакцию, которая протекает в закрытой системе A + B «C + D. Скорость прямой реакции описывается уравнением
где С течением времени концентрации реагентов А и В уменьшаются, скорость реакции снижается (рис.4.7, кривая Реакция между А и В приводит к образованию веществ C и D, молекулы которых при столкновениях могут вновь дать вещества А и В.
Рис. 4.7. Изменение скоростей прямой и обратной реакций во времени Скорость обратной реакции описывается уравнением
где По мере того как концентрации веществ C и D возрастают, скорость обратной реакции увеличивается (рис.4.7, кривая В какой-то момент времени скорости прямой и обратной реакций становятся равными
Такое состояние системы называется состоянием равновесия. В состоянии равновесия концентрации всех его участников перестают меняться во времени. Такие концентрации называются равновесными. Равенство скоростей прямой и обратной реакций – это кинетическое условие химического равновесия. 4.14.2. Константа равновесия При равенстве скоростей прямой и обратной реакций
справедливо равенство
где [ A ], [ B ], [ С ], [ D ] – равновесные концентрации веществ. Поскольку константы скоростей не зависят от концентраций, равенство можно записать иначе:
Отношение констант скоростей прямой и обратной реакций (
Константа равновесия является постоянной величиной для данной реакции при данной температуре. Величина константы равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации реагирующих веществ.Она показывает соотношение между концентрациями продуктов реакции и исходных веществ, которое устанавливается при равновесии. Рассмотрим сложную реакцию aA + bB «cC + dD. Любую сложную химическую реакцию можно представить в виде ряда простых реакций. Для каждой из простых реакций можно записать кинетическое уравнение прямой и обратной реакций и соответствующие им выражения для констант равновесия. Константа равновесия сложной реакции равна произведению констант равновесия простых реакций, описывающих ее механизм
Поэтому в суммарное выражение для константы равновесия равновесные концентрации войдут в степенях их стехиометрических коэффициентов:
|

 ,
,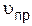 – скорость прямой реакции;
– скорость прямой реакции;  – константа скорости прямой реакции.
– константа скорости прямой реакции.
 ,
, – скорость обратной реакции;
– скорость обратной реакции;  – константа скорости обратной реакции.
– константа скорости обратной реакции. .
. ,
, .
.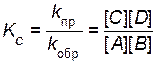 .
.
 .
. .
.



