Потенциалы газовых электродов
Газовыеэлектроды могут быть обратимыми относительно анионов (кислородный) или относительно катионов (водородный). Газовые электроды состоят из металлического проводника (Pt или металлов платиновой группы), контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для подвода и отвода электронов, а также является катализатором электродной реакции (ускоряет установление равновесия на электроде). Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то потенциалы этих электродов зависят от парциальных давлений газов. Равновесие на водородном электроде выражается уравнением 2Н++ 2
где Е 2Н+ / Н2 = −0,059 рН. (8.6) Подставляя числовые значения R, F, стандартной температуры, равной Т =298 К, и учитывая, что lgH+ =−pH, уравнение Нернста при р Н Кислородный электрод состоит из платиновой пластинки, контактирующей с кислородом и раствором, содержащим ионы, которые образуются при восстановлении кислорода (ионы ОН-): О2, Pt │ОН-. Если на кислородном электроде протекает реакция по уравнению 2Н2О + О2 + 4 то выражение равновесного потенциала при Т = 298 К имеет вид:
Так как активность воды в ходе реакции изменяется незначительно, то ее считают величиной постоянной и уравнение для расчета потенциала кислородного электрода при подстановке значений R, F и T = 298 К приобретает вид:
где Е о2Н Проведя ряд преобразований, получаем уравнение Нернста для расчета кислородного электрода в виде:
Зависимости значений равновесных потенциалов водородного и кислородного электродов от рН приведены в приложении (табл. 14).
|


 Н2. Уравнение Нернста для расчета потенциала водородного электрода имеет следующий вид:
Н2. Уравнение Нернста для расчета потенциала водородного электрода имеет следующий вид: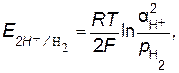 (8.5)
(8.5) −активность ионов Н+ в электролите; р Н
−активность ионов Н+ в электролите; р Н  −парциальное давление водорода.
−парциальное давление водорода.
 (8.7)
(8.7)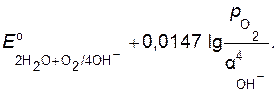 (8.8)
(8.8) О+О
О+О  ОН- =1 моль/л).
ОН- =1 моль/л). =1,229−0,059рН. (8.9)
=1,229−0,059рН. (8.9)


