Примеры решения типовых задач. Пример 1. Укажите, с какими из указанных растворов (FeSO4, CuSO4 и Na2SO4) будет взаимодействовать никель при стандартных условиях?
Пример 1. Укажите, с какими из указанных растворов (FeSO4, CuSO4 и Na2SO4) будет взаимодействовать никель при стандартных условиях? Приведите уравнения возможных реакций. Решение. Возможность взаимодействия металла с раствором соли и вытеснения из данного раствора металла, входящего в эту соль, можно определить на основании значений стандартных электродных потенциалов металлов (ряд напряжений). Каждый металл этого ряда вытесняет (восстанавливает) из растворов солей только те металлы, ионы которых расположены за ним, т.е. имеют более высокие значения электродных потенциалов. Из табличных данных (Прил., табл. 12) находим значения E o Меn+ / Me для никеля и металлов, ионы которых входят в состав солей: E oNi2+ / Ni=−0,25 B; E o Fe2+ / Fe=−0,44 B; E oCu2+/ Cu=+0,34 В; E oNa+/ Na=−2,71 B. Следовательно, из предлагаемых растворов солей никель способен вытеснить только медь, так как E oCu2+/ Cu> E oNi2+ / Ni. Уравнение реакции имеет вид: Ni + CuSO4 ↔ NiSO4 + Cu, восстановитель ½Ni окислитель ½Cu2+ + 2 Пример 2. Рассчитайте электродный потенциал меди, находящейся в растворе сульфата меди с концентрацией ионов [Cu2+ ]=0,001 моль/л. Решение. Электродный потенциал металла вычисляется по уравнению Нернста. В табл. 12 приложения находим значение стандартного электродного потенциала E oCu2+/Cu =+0,34 В. E Cu2+/ Cu =+0,34 + Пример 3. Вычислите электродный потенциал для водородного электрода при температуре 25 оС и парциальном давлении Н2 1 атм, рН которого равен 3. Решение. Уравнение Нернста для расчета потенциала водородного электрода в разных средах: Пример 4. Вычислите потенциал кислородного электрода в растворе с концентрацией ионов [Н+]=10-1 моль/л при температуре 25 оС и парциальном давлении О2 1 атм. Решение. Уравнение Нернста для расчета потенциала кислородного электрода в разных средах: Е O2+2H2O / 4OH- = Е оO2+2H2O / 4OH-+0,059рОН. Учитывая, что рН+рОН=14 и рН=− lg[H+], рассчитываем потенциал кислородного электрода: Е O2+2H2O / 4OH- =0,4+0,059х13=1,167 В. Пример 5. Рассчитайте ЭДС гальванического элемента Fe/ Fe(NO3)2 IIAgNO3/Ag при концентрации раствора Fe(NO3)2, равной 0,1 моль/л и концентрации раствора [AgNO3]=0,001 моль/л. Решение. E Fe2+ / Fe = −0,44+ E Ag+ / Ag = +0,8+0,059 lg10-2 =+0,682 B. Следовательно, железный (Fe) электрод является анодом, серебряный (Ag) – катодом. ЭДС= Е к– Е а=+0,682–(–0,4695)=1,1515 В.
|

 Ni2+ + 2
Ni2+ + 2  (процесс окисления);
(процесс окисления); =0,25 В.
=0,25 В. =−0,059рН. Вычисляем потенциал водородного электрода при рН=3.
=−0,059рН. Вычисляем потенциал водородного электрода при рН=3.  3=−0,017 В.
3=−0,017 В.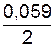 lg10-1=0,44+(−0,0295)=–0,4695 B;
lg10-1=0,44+(−0,0295)=–0,4695 B;


