
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
ЛАБОРАТОРНА РОБОТА №1
Дата добавления: 2014-10-22; просмотров: 877
|
|
| Кислота | Кислотный остаток | ||
| Формула | Название | Формула | Название |
| H3AsO4 | Ортомышьяковая | AsO43- | Ортоарсенат |
| HAsO3 | Метамышьяковая | AsO3- | Метаарсенат |
| H3BO3 | Ортоборная | BO33- | Ортоборат |
| HBO2 | Метаборная | BO2- | Метаборат |
| HClO4 | Хлорная | ClO4- | Перхлорат |
| H2CrO4 | Хромовая | CrO42- | Хромат |
| H2Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HIO3 | Йодноватая | IO3- | Иодат |
| HMnO4 | Марганцевая | MnO4- | Перманганат |
| HNO2 | Азотистая | NO2- | Нитрит |
| HNO3 | Азотная | NO3- | Нитрат |
| H3PO4 | Ортофосфорная | PO43- | Ортофосфат |
| H2SO3 | Сернистая | SO32- | Сульфит |
| H2SO4 | Серная | SO42- | Сульфат |
| H2SiO3 | Метакремниевая | SiO32- | Метасиликат |
ОГЛАВЛЕНИЕ
Введение 3
Общие методические указания 3
1. Основные понятия и законы химии 4
Задачи к главе 1 11
2. Состав и строение атома. Химическая связь 13
2.1. Состав атома 13
2.2. Строение электронных оболочек 14
2.3. Геометрические и энергетические характеристики атомов 15
2.4. Химическая связь 16
Задачи к главе 2 17
3. Химическая термодинамика 20
3.1. Термохимия 21
3.2. Химическое сродство 22
Задачи к главе 3 24
4. Химическая кинетика и равновесие 28
4.1. Химическая кинетика 28
4.2. Химическое равновесие 31
Задачи к главе 4 34
5. Растворы. Способы выражения состава 37
Задачи к главе 5 38
6. Свойства растворов неэлектролитов 40
Задачи к главе 6 42
7. Свойства растворов электролитов 43
7.1. Электролитическая диссоциация 43
7.2. Произведение растворимости 46
Задачи к главе 7 46
8. Ионное произведение воды. Водородный показатель 48
Задачи к главе 8 49
9. Ионообменные реакции. Гидролиз солей 49
Задачи к главе 9 53
10. Комплексные соединения 55
Задачи к главе 10 57
11. Окислительно-восстановительные реакции 57
Задачи к главе 11 60
12. Электрохимические явления 63
12.1. Гальванический элемент 63
12.2. Электролиз 67
Задачи к главе 12 71
Приложения 74
КИЇВ КДАВТ 2003
Методичні вказівки до лабораторних робіт з курсу «Хімія для студентів спеціальностей «Судноводіння на морських і внутрішніх водних шляхах» та «Експлуатація суднових енергетичних установок».
Укл. Т.О.Сєрова ст. викладач.
ЛАБОРАТОРНА РОБОТА №1
| Тема: | Основні класи неорганічних сполук. Оксиди, основи. | |
| Мета: | Ознайомитись з методами одержання основ, їх хімічними властивостями. | |
| Реактиви: | ||
| Розчини: | - Натрій гідроксид; | |
| - Купрум (ІІ)сульфат; | ||
| - Кальцій гідроксид. | ||
| Тверді речовини: | - Кальцій оксид; | |
| - Купрум (ІІ) оксид. | ||
| Індикатори: | ||
| - Метилоранж; | ||
| - Лакмус; | ||
| - Фенолфталеїн. | ||
| Обладнання: | Хімічний штатив, пробірки, фізичний штатив, бюретки, скляна паличка |
1.1 Методичні вказівки до вивчення теоретичного матеріалу
До основних класів неорганічних сполук належать оксиди, кислоти, основи, солі.
Оксидами називають сполуки елементів з киснем, ступінь окислення якого –2. Так, Са2+О2- - кальцій оксид, а Са2+О2 – кальцій пероксид (містить пероксидну групу –0 –0 -).
За хімічним характером оксиди поділяють на солетворні і несолетворні (NO, CO. SiO та ін.). Солетворні оксиди, в свою чергу, поділяють на основні, кислотні, амфотерні.
Основними називають оксиди, гідратами яких є основи. Це оксиди металів у нижчих ступенях окислення. Серед них тільки оксиди лужних і лужноземельних металів реагують з водою, утворюючи розчинні у воді основи – луги:
Li2O+H2O=2LiOH
Кислотними називають оксиди, гідратами яких є кислоти. Їх також називають ангідридами відповідних кислот. Це оксиди неметалів (SO2, N2O3, SO3…) і деякі оксиди металів у вищих ступенях окислення (Mn2O7, V2O5, CrO3…). Кислотні оксиди взаємодіють з водою з утворенням кислот (виняток SiO2).
SO2+H2O=H2SO3
Амфотерними називають оксиди, які залежно від умов виявляють властивості основних і кислотних оксидів. Наприклад, BeO, ZnO, Al2O3, Cr2O3, Fe2O3, MnO2 та ін. З водою не взаємодіють.
Методи добування то основні властивості оксидів детально описані в наведених підручниках. Слід звернути увагу на зв’язок між властивостями хімічних елементів, ступенем їх окислення і хімічним характером оксидів та гідроксидів, що утворюються. Так, хром (ІІ) оксид CrO – основний, хром (ІІІ) оксид Cr2O3 – амфотерний, а хром (VI) оксид CrO3 – кислотний. Їм відповідають хром гідроксид Cr(OH)2 , амфотерний хром гідроксид Cr(OH)3 і хромова кислота H2CrO4. Тобто хімічний характер оксидів із зростанням ступеня окислення змінюється від основного через амфотерний до кислотного. Таким же чином і в межах малих періодів і рядів великих періодів із збільшенням порядкового номера елементів змінюється характер вищих оксидів від основних через амфотерні до кислотних.
При вивченні номенклатури необхідно запам’ятати технічні назви деяких оксидів і гідроксидів, які використовуються в будівництві. Наприклад, СаО – гашене вапно, MgO – палена магнезія, Al2O3 – глинозем, SiO2 – кварц, пісок та ін.
Найскладнішим у вивченні цієї теми є розуміння поняття “амфотерність”. Амфотерність – це властивість оксидів і гідроксидів залежно від умов перебігу процесу реагувати як з кислотами, так і з основами.
З кислотами амфотерні оксиди реагують як основні оксиди, а амфотерні гідроксиди – як слабкі основи з утворенням солей відповідних кислот:
Al2O3+6HCl=2AlCl3+3H2O
Характер продуктів реакції амфотерних оксидів і гідроксидів з гідроксидами і карбонатами активних металів залежить від умов.
У водних розчинах реакції відбуваються з утворенням комплексних гідроксосолей:
| натрій тетрагідроксоалюмінат |
Al2O3+3H2O+2NaOH=2Na[Al (OH4)]
Al(OH)3+ NaOH(P-H)_  Na[Al (OH4)]
Na[Al (OH4)]
натрій гексогідроксоалюмінат
Al (OH)3+ 3NaOH 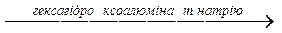 Na3[Al (OH6)]
Na3[Al (OH6)]
натрій метаалюмінат

При високій температурі утворюються безводні солі:
to
 Al2O3+2NaOH 2Na[Al (OH4)] натрій метаалюмінат
Al2O3+2NaOH 2Na[Al (OH4)] натрій метаалюмінат
to
 Al2O3+СаСО3 Са(AlO2)2+СО2↑ кальцій метаалюмінат
Al2O3+СаСО3 Са(AlO2)2+СО2↑ кальцій метаалюмінат
При вивченні основ необхідно звернути увагу на їх кислотність. Це поняття використовують у багатьох хімічних розрахунках. Кислотність дорівнює кількості гідроксогруп ОН- , які зв’язані із катіоном металу в основі, або заміщені в хімічній реакції. Так, NH4OH – амоній гідроксид – це однокислотна основа.
Запам’ятайте, що одно - і багатокислотні основи можуть утворювати один, або кілька основних залишків. Основний залишок – це група атомів, яка утворюється внаслідок ступінчатого відриву від основи гідроксогруп ОН-.
| Основи |
NaOH  Na+
Na+
Al (OH)3  Al (OH)+2
Al (OH)+2
Al (OH)+2  Al (OH) 2+
Al (OH) 2+ 
Al (OH) 2+  Al3+
Al3+
Al (OH)3  Al (OH)+2
Al (OH)+2  Al (OH) 2+
Al (OH) 2+  Al3+
Al3+
Зверніть увагу на позитивний заряд основних залишків.
1.2 Проведення дослідів
| <== предыдущая лекция | | | следующая лекция ==> |
| Висновки | | | ЛАБОРАТОРНА РОБОТА №2 |