
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
ЛАБОРАТОРНА РОБОТА №13
Дата добавления: 2014-10-22; просмотров: 1062
|
|
| Тема: | Корозія металів, захист металів від корозії. | |
| Мета: | Встановити закономірності проходження електрохімічної корозії та ознайомитися з методами захисту від корозії. | |
| Реактиви: | ||
| Розчини: | - Червона кров’яна сіль; | |
| - Хлорид натрію; | ||
| - Сірчана кислота; | ||
| - Уротропін. | ||
| Індикатори: | - Фенолфталеїн. | |
| Обладнання: | Електролізер, залізні стрижні, гальванічна пара (Fe, Al), джерело постійного струму. |
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Корозією називається руйнування металу в результаті хімічного чи електрохімічного впливу навколишнього середовища.
Хімічна корозія протікає в результаті прямої хімічної взаємодії металів з агресивним навколишнім газоподібним середовищем, у результаті чого на поверхні утворяться продукти взаємодії: оксиди, сірчисті сполуки і т.д.
Електрохімічна корозія відбувається на границі розділу фаз: метал – електроліт. Електролітом може служити вода з присутніми в ній іонами кислот, солей.
Корозія може мати місце також при дії вологого ґрунту, вологи повітря.
Відповідно до теорії електрохімічної корозії металів при електрохімічній корозії протікають процеси, аналогічні тим, що виникають у гальванічних елементах.
Можливими причинами виникнення корозії гальванічних елементів є наступні:
1) контакт металів з різним значенням стандартного електродного потенціалу, що знаходяться в розчині електроліту;
2) хімічна неоднорідність того самого металу. Так, сталь має включення часток карбіду заліза – цементиту (Fe3C);
Залізо і цементит володіють різними електродними потенціалами. При зануренні сталі в агресивне середовище, на її поверхні виникає безліч мікроелементів;
3) фізична неоднорідність металу за рахунок нерівномірних чи деформацій нерівномірності прикладених зовнішніх навантажень, що приводить до дефектів кристалічних граток і зміни електродних потенціалів;
4) порушення лакофарбового покриття, розходження в складі і концентрації електроліту, що стикається з тим самим металом, різна швидкість руху електроліту на поверхні металу і т.п.
Електрохімічна корозія має місце у випадку контакту двох різних металів.
Електрохімічна корозія супроводжується протіканням двох реакцій: анодної і катодної. Анодний процес полягає в окислюванні більш активного металу.
Анодна реакція:
| +n | |||
| Ме - | 4 ē = | Ме | - окислення |
Катодний процес залежить від характеру електроліту.
У кислотному середовищі окислювачем є Н+, тому реакція на катоді буде наступна:
Середовище кисле:
| + | 0 | ||
| 2Н + | 2 ē = | Н2 | процес відновлення |
У нейтральному середовищі, крім процесів окислювання і відновлення, протікає вторинна реакція:
Me+n + nOH- = Me(OH)n - утворення гідроксидів.
Як приклад розглянемо процес електрохімічної корозії в кислому і нейтральному середовищах при контакті цинку і свинцю.
Стандартний електродний потенціал цинку 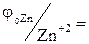 -0,763 В, а свинцю
-0,763 В, а свинцю  -0,126 В. З двох розглянутих металів цинк є більш активним, отже, він буде піддаватися процесу окислювання. Запишемо електрохімічні схеми корозійних елементів:
-0,126 В. З двох розглянутих металів цинк є більш активним, отже, він буде піддаватися процесу окислювання. Запишемо електрохімічні схеми корозійних елементів:
- у кислому середовищі: Θ Zn½HCl½Pb Å;
- у нейтральному середовищі: Θ Zn½H2О, О2½Pb Å.
Реакція на аноді у кислому та в нейтральному середовищах буде та сама:
| Zn - | 2ē = | Zn+2 | - процес окислення |
На катоді в кислому середовищі:
| 2Н+ + | 2ē = | Н20 | - процес відновлення |
На катоді в нейтральному середовищі:
| 2Н2О + | О2 + | 4ē = | 4ОН- | - процес відновлення |
Вторинна реакція в нейтральному середовищі:
Zn+2 + 2ОH- = Zn(OН)2 .
Руйнування металу, що знаходиться в контакті з менш активним металом, протікає значно інтенсивніше, ніж без нього. Тому щоб уникнути корозії необхідно стежити, щоб такі контакти не створювалися.
Електрохімічна корозія підкоряється законам електролізу Фарадея і кількість металу, що прокородувала, можна розрахувати по формулі:
 ,
,
де  маса речовини, що прокородувала, у м;
маса речовини, що прокородувала, у м;
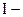 сила струму, в А;
сила струму, в А;
Е – хімічний еквівалент металу;
96500 – число Фарадея.
У розвитку корозійних процесів важливе місце займає природа електролізу. Чим більше міститься у воді розчинних солей чи кислот, основ, тим вище її електропровідність, тим сильніше руйнуються в такому середовищі метали. Саме тому морська вода, що містить солі, що добре дисоціюють, володіє високою електропровідністю, є більш агресивним середовищем для металів, чим річкова. Крім того, сильним активатором корозії в морській воді є іони Cl-, що в більшому ступені, ніж інші іони, руйнують метал.
Захист металів від корозії.
Основними видами захисту металів від корозії є:
1) нанесення захисних покриттів на метал;
2) обробка корозійного середовища;
3) електрохімічний захист (катодний і протекторний).
1. Захисні покриття можуть бути:
- на полімерній основі (полімерні, лакофарбові, мастила),
- на неорганічній основі (оксидні, фосфатні, емалеві й ін.),
- металеві.
По своїй електрохімічній природі металеве покриття може бути двох типів: покриваючий метал може відігравати роль катода чи роль анода.
Анодне покриття захищає метал і механічно і электрохімічно. При порушенні цілісності покриття, воно буде відігравати роль анода і руйнуватися, захищаючи метал, на якому будуть протікати процеси відновлення.
Прикладом анодного покриття є цинк на залізі – оцинковане залізо. Катодне покриття захищає метал тільки механічно. Як тільки цілісність покриття порушується, виникає гальванічна пара металів, у якій анодом є основний метал, а покриття – катодом. Прикладом є луджене залізо, залізо, покрите оловом.
2. Боротьба з корозією шляхом обробки корозійного середовища може виконуватися тільки за умови її обмеженого обсягу шляхом:
а) зменшення вмісту або видалення з корозійного середовища речовин, що викликають корозію;
б) введення інгібіторів.
3. Електрохімічний протекторний захист.
Принцип дії протекторного захисту аналогічний дії анодного покриття. Як протектор використовують метал з більш електронегативним потенціалом. Наприклад, для захисту від корозії корпуса судна застосовуються як протектор бруски зі сплавів на основі цинку, магнію чи алюмінію. Протектор з'єднується з корпусом судна, що захищається. Виникає електрохімічний елемент, у якому катодом є корпус судна, що захищається, а метал протектора – розчинним анодом.
Електрохімічний катодний захист може бути здійснений за допомогою зовнішнього джерела постійного струму. Металеві конструкції, що захищаються, підключаються до негативного електрода.
Метал, що охороняється, у цьому випадку не піддається впливу корозійного середовища, на його поверхні йдуть тільки відновні процеси. До позитивного полюса зовнішнього джерела струму підключається метал – анод, на якому протікає процес окислювання.
1.2Проведення дослідів
| <== предыдущая лекция | | | следующая лекция ==> |
| ЛАБОРАТОРНА РОБОТА №12 | | | ЛАБОРАТОРНА РОБОТА №14 |