
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
ЛАБОРАТОРНА РОБОТА №15
Дата добавления: 2014-10-22; просмотров: 769
|
|
| Тема: | Визначення еквіваленту мармуру. | |
| Мета: | Експериментальним шляхом визначити еквівалентну масу мармуру. | |
| Реактиви: | Розчини: | - Соляна кислота; |
| Тверді речовини: | - Мармур. | |
| Обладнання: | Прилад для визначення еквівалентів речовин. |
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Перед виконанням роботи необхідно повторити основні поняття і закони хімії, вивчити поняття “хімічний еквівалент” та “еквівалентна маса” речовини.
Зверніть увагу, що в багатьох сучасних підручниках замість терміна “еквівалентна маса” використовується термін “молярна маса еквівалента”. Відповідно до цього хімічний еквівалент позначають Е, а молярну масу еквівалента (еквівалентну масу) МЕ.
Для розрахунку еквівалентних мас простих і складних речовин зручно користуватись формулою:
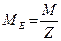 (формула І)
(формула І)
де М – молярна маса речовини; Z – величина, що змінюється залежно від класу речовини. Приклади використання цієї формули для різних класів речовин наведені в таблиці 1.1
таблиця 1.1
Розрахунки еквівалентних мас простих і складних речовин
| Клас речовини | Значення Z | Приклад |
| Проста речовина | Валентність елемента Z = 3 | 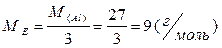
|
| Кислота | Основність(в даній реакції) а) Z = 3 б) Z = 1 |
а) H3 PO4 + 3NaOH = Na3 PO4 + 3H2O ;
 б) H3 PO4 + 3NaOH = NaН2PO4 + H2O ;
б) H3 PO4 + 3NaOH = NaН2PO4 + H2O ;

|
| Основа | Кислотність (в даній реакції) а) Z = 2 б) Z = 1 |
а) Са(ОH)2 + 2 HCl = CaCl2 + 2 H2 O ;
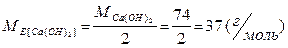 б) Са(ОH)2 + 2 HCl = CaОНCl + H2O ;
б) Са(ОH)2 + 2 HCl = CaОНCl + H2O ;

|
| Оксид | Z = B · n = 6 Добуток валентності елемента, який зв’язаний з киснем, на кількість його атомів у формулі |
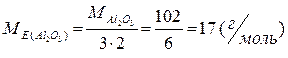
|
| Сіль | Z = B · n = 6 Добуток заряду основного залишку на кількість основних залишків у формулі солі |
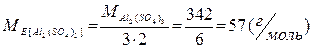
|
Запам’ятайте, що всі речовини реагують між собою в еквівалентних кількостях. В цьому полягає один з основних законів хімії – закон еквівалентів. Цей закон можна сформулювати по-іншому: маси (об’єми) реагуючих речовин прямо пропорційні їх еквівалентним масам (об’ємам). Математично закон еквівалентів записують у кількох варіантах:
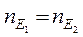

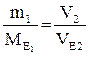
де m1, m2 – маси реагуючих речовин;
V2, 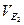 - об’єм та еквівалентний об’єм однієї з реагуючих речовин;
- об’єм та еквівалентний об’єм однієї з реагуючих речовин;
nЕ – кількість еквівалентів речовини.
Найчастіше всі розрахунки проводять, використовуючи значення еквівалентних об’ємів кисню чи водню. Ці величини постійні і дорівнюють:
 ;
;  ;
;
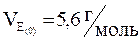 ;
; 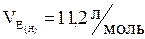 .
.
1.2 Проведення дослідів
| <== предыдущая лекция | | | следующая лекция ==> |
| ЛАБОРАТОРНА РОБОТА №14 | | | Дослід № 1 |