
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Дослід 2. Вплив температури на швидкість хімічної реакції.
Дата добавления: 2014-10-22; просмотров: 772
|
|
а) Взяти дві пробірки і відміряти по 10 крапель натрій тіосульфату і додати по 5 крапель води.
б) Помістити обидві пробірки в склянки з гарячою водою і нагріти розчини у пробірках: першу на 10 градусів Цельсію в порівнянні з початковою температурою, а другу ще на 10 градусів Цельсію в порівнянні з першою.
в) Додати по одній краплі розчину сульфатної кислоти в пробірку з тіосульфатом не виймаючи з води та ввімкнути секундомір і заміряти час початку опалесценції
г) Одержані результати занести у таблицю №2
Б) Хімічна реакція зі зміною температури
| N | концентрація Na2S2O3 | кількість Na2S2O3 | кількість H2 O | Кількість H2 SO4 | кімнатна t 0С | Час початку опалесценції с. | відносна швидкість реакції | температурний коеф. |
| М 0,15 М 0,15 М 0,15 |
Обробка результатів досліду :
1. Розрахувати відносні швидкості реакцій і зробити висновок про вплив зміни концентрації на швидкість хімічної реакції.
2. Вичислити температурний коефіцієнт і зробити висновок відносно впливу температури на швидкість хімічної реакції. Формула для розрахунку швидкості хім. реакції:
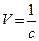 де c - час початку опалесценції;
де c - час початку опалесценції;
Формула для розрахунку температурного коефіцієнта:
де Vп - швидкість реакції при нагріванні на 10 градусів
 а Vк - швидкість реакції при кімнатній температурі
а Vк - швидкість реакції при кімнатній температурі
Контрольні питання:
1. Які умови потрібні для початку хімічної реакції?
2. Що таке енергія активації?
3. Дати визначення швидкості хімічної реакції для гомогенних і гетерогенних процесів.
4. Сформулювати закон діючих мас.
5. Залежність швидкості хімічної реакції від температури, тиску, концентрації.
6. Що таке константа швидкості хімічної реакції? Від яких чинників залежить константа?
7. Що таке каталіз (гомогенний, гетерогенний)?
8. Що таке інгібітори?
9. Вимоги до промислових каталізаторів.
| <== предыдущая лекция | | | следующая лекция ==> |
| ЛАБОРАТОРНА РОБОТА №3 | | | ЛАБОРАТОРНА РОБОТА №4 |