Твердые растворы замещения. Изоморфизм
Если атомы или ионы одного вещества, внедряясь в решетку другого вещества, замещают его собственные атомы или ионы в узлах решетки, возникают твердые растворы замещения. Твердыми растворами замещения называются такие растворы, которые образуются в результате статистического замещения атомов или ионов в структуре какого-либо кристаллического вещества (растворителя или матрицы) атомами или ионами другого (растворенного вещества, занимающими в результате этого регулярные узлы кристаллической решетки. Твердые растворы замещения часто называют также смешанными кристаллами и изоморфными смесями, а процесс образования твердых растворов замещения называют изоморфным замещением. Твердые растворы замещения называют растворами первого рода. Изоморфизм – свойство атомов, ионов, молекул замещать друг друга в структуре, называют изоморфными. Если замена одного атома (иона) другим происходит в любых количествах, изоморфизм называют совершенным, если ограниченно – несовершенным. Если атомами В замещается небольшое количество атомов А, атомы В называются изоморфными примесями. При замещении большого количества атомов А на атомы В получаются смешанные кристаллы или твердые растворы. Кристаллизация из раствора или расплава какого-либо компонента в присутствии посторонних атомов может проходить тремя путями: 1) энергия кристаллической решетки при введении посторонних атомов резко возрастает, твердый раствор не стабилен и образуются две самостоятельные фазы; 2) энергия кристаллической решетки при введении посторонних атомов резко снижается, образуется новое химическое соединение; 3) энергия меняется незначительно, повышение энтропии за счет беспорядоченного размещения в кристалле посторонних атомов приводит к тому, что твердый раствор будет иметь более низкую свободную энергию и состояние сиситемы станет стабильным Бывают случаи, когда при высокой температуре два соединения образуют непрерывный ряд твердых растворов, а при снижении температуры начинается их распад. Примером могут служить калиевый и натриевый полевые шпаты (ортоклаз и альбит), которые при высоких температурах образуют твердый раствор – анортоклаз. При низких температурах происходит распад этого твердого раствора на мелкие кристаллы каждого компонента. Изоморфизм возможен лишь при одинаковом координационном числе атомов, а в соединениях с ковалентной связью – при тождественной конфигурации связи. Эти условия являются обязательными, но недостаточными. Дополнительными условиями изоморфизма является близость размеров взаимозаменяемых ионов, одинаковая поляризуемость и одинаковое строение их электронных оболочек. Как правило, для совершенного изоморфизма необходимо, чтобы различие в величинах ионных радиусов основного и примесного компонентов не превышало 15 %. В противном случае замещение происходит или в ограниченных размерах, или при высокой температуре. Так, радиусы ионов натрия и кальция близки по размеру и составляют 0, 98·10-10 и 1, 04·10-10м соответственно, поэтому натриевый и кальциевый полевые шпаты образуют непрерывный ряд твердых растворов. Различают изовалентный и гетеровалентный изоморфизм. При изовалентном изоморфизме происходит замещение равнозарядных ионов. Пример изовалентного изоморфизма в силикатах – замена Мg2+ на Fe+2 в оливинах (Мg, Fe)2 [SiО4], взаимозамена Са2+, Мg2+, Fe+2 и Аl3+, Fe3+, Cr3+ в гранатах. При гетеровалентном изоморфизме замещаются разнозарядные ионы. Пример гетеровалентного изоморфизма – замена Si4+ на Аl3+ в алюмосиликатах, Si4+ на В3+ в боросиликатах, а также замена Na+ на Са2+, Мg2+ на Аl3+ и др. При гетеровалентном изоморфизме сумма положительных зарядов должна обязательно равняться сумме отрицательных зарядов. Наиболее часто встречающимися в силикатах парами взаимозаменяемых элементов являются: Na+ + Si4+ ↔ Са2+ + Аl3+ Са2+ + Аl3+↔ Мg2+ + Се3+ 2Са2+ ↔ Na+ + Се3+ Li+ + Аl3+↔ 2Са2+ Гетеровалентное замещение характерно также для анионов: кислород замещается ионами F- или Сl-. Изоморфными, согласно Митчерлиху, следует называть вещества, которые при различном химическом составе обладают значительными, а иногда и полным сходством их кристаллической структуры. Изоморфные вещества характеризуются наличием аналогичных или близких по своей природе сил химической связи. Они обнаруживают весьма характерное свойство, заключающиеся в способности при совместной кристаллизации из растворов или расплавов образовывать вполне однородные кристаллы с переменным содержанием компонентов. Такие кристаллы получили название твердых растворов. Явление образования твердых растворов необычайно широко распространены среди различных групп кристаллических силикатов - оливина, пироксенов, слюд, гранатов и тд. Для исследования силикатных систем особенно ценны диаграммы, характеризующие зависимость оптических свойств твердых растворов от их химического состава; при помощи таких графиков можно очень быстро и достаточно точно определить по оптическим константам составы тверды растворов. Твердые растворы бывают с ограниченной и неорганической смешиваемостью (растворимостью) 1. замещение (в узлах решетки ионы (атомы) растворителя замещаются ионами (атомами)растворяющегося вещества); 2. внедрение (элементы растворенного вещества располагаются в межузловых промежутках решетки растворителя); 3. вычитание (остаются вакантными некоторые позиции одного или нескольких сортов ионов (атомов) растворенного компонента или обоих компонентов твердого раствора.)
Полиморфизмом называется способность вещества одного и того же состава существовать в зависимотси от внешних условий в нескольких кристаллических формах (полиморфных модификациях) с различной структурой (для простых веществ это явление иногда называется аллотропией) Полиморфизм широко распространен в природе и является одним из характерных свойств кристаллических веществ. Полиморфные модификации, отличаясь внутренней структурой, имеют в связи с этим различные свойства. К внешним условиям, определяющим полиморфизм, относятся прежде всего температура и давление, поэтому каждая полиморфная модификация имеет свою область температуры и давлений, при которых же существует в термодинамически стабильном (равновесном) состоянии и вне которых она стабильна быть не может, хотя и может существовать в метастабильном, то есть неравномерном состоянии. Например: такие оксиды как CaO и MgO не имеют полиморфных форм, SiO2 – обладает ярко выраженном полиморфизмом. Независимо от характера структурных изменений, происходящих при полиморфных превращениях, различают две их разновидности: энантиотропные (обратимые) и монотропные (необратимые) превращения. Примером энантиотропных полиморфных превращений являются превращения между полиморфными формами SiO2 .
Примером монотропных превращений являются переходы (при обычном давлении):
TiO2 (брукит) Полиморфные превращения относятся к твердофазовым процессам, контролируемые процессом диффузии. При повышении температуры подвижность атомов в структуре возрастает и, следовательно, скорость полиморфного превращения увеличивается. При охлаждении, и наоборот, она уменьшается. Особым случаем полиморфизма является так называемый политипизм, заключающийся в том, что вещество может кристаллизоваться в нескольких модификациях. Классическим примером соединения, обладающего политипизмом является карборунд Полиморфизм некоторых глинистых минералов, а так же некоторых других слоистых силикатов, например слюд, возникает часто как следствие различных способов укладки слоев в их структурах, что так же может рассматриваться как один из случаев проявления политипизма Однокомпонентная система SiO2 является системой со сложным полиморфизмом. Насчитывается 10 кристаллических и две стеклообразные формы SiO2 . Превращение модификаций SiO2 подчиняется следующей схеме (по Феллеру):
870 1470 1728
167 230
120
Главными модификациями SiO2 является кварц, тридимит, кристаболит. Кодификационные превращения кристаллических разновидностей кремнезема можно разделить на две группы: быстро протекающие и медленно протекающие. К первой группе относятся превращения модификаций в пределах 1 минеральной разновидности:
Эти превращения сопровождаются небольшими изменениями в решетки кремнезема. Ко второй группе относятся превращения из одной минеральной разновидности в другую:
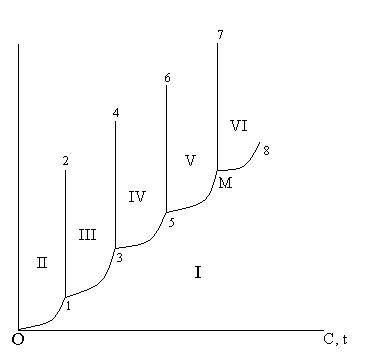
Эти превращения сопровождаются глубокой перестройкой решетки. Устойчивыми модификациями в этой системе являются четыре твердые фазы:
Она жидкая фаза – расплав, одна газообразная фаза – пар.
Линия 0 – 1 – 3 – 5 –М – 8 делит плоскость между координатными осями на две части. В I части все точки отображают такие условия: температура, давление, при которых SiO2 находится в виде пара. Область II поле Область III поле Область IV поле Область VI поле расплава. При этом линия 1– 2 представляет условие равновесного состояния между Тройные точки 1 – 3 – 5 характеризуют равновесное состояние двух твердых фаз и пара SiO2 . Точка М – равновесное состояние Превращение Если расплав SiO2 охлаждать быстро, то он не успевает закристаллизоваться и застывает в виде стеклообразной массы (кварцевого песка) Во всех этих кодификационных превращениях изменяется плотность. Общее увеличение плотности составляет 16, 5%. Это имеет большое значение в производстве. Кроме этих модификаций кремнезема открыто еще 4 новых модификации: коэсит, китит, стишовит, волокнистый SiO2 . все полиморфные модификации SiO2 отличаются друг от друга оптическими свойствами плотностью, коэффициентом линейного расширения, строением кристаллической решетки и другими.
|




 кварц
кварц 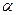 кварц
кварц 


 575
575
 тридимит
тридимит