Лекция № 19
Тема: Однокомпонентные системы SiO2, Al2O3, MgO, ZrO2 1.Однокомпонентная система SiO2 2.Однокомпонентные системы Al2O3, MgO, ZrO2
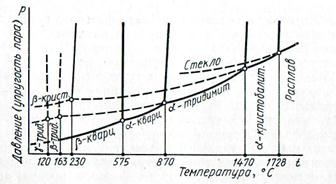
Система SiО2 Единственным устойчивым оксидом кремния является кремнезем — SiО2. Однокомпонентная диаграмма состояния системы SiО2, построенная К. Феннером, приведена на рис.21. Эта диаграмма имеет существенное значение для технологии производства динасовых огнеупоров, изделий тонкой керамики (фарфор, фаянс), кварцевого стекла и т. д., в которых SiО2 является основной или весьма важной составной частью.
Рис. 21. Диаграмма состояния системы SiО2
Кремнезем образует много полиморфных модификаций, из которых на диаграмме Феннера представлены только основные формы SiО2, встречающиеся в обычных условиях в природных и технических продуктах. Как видно из диаграммы, SiО2 образует три главные модификации: кварц, тридимит и кристобалит, каждая из которых в свою очередь имеет несколько разновидностей— модификаций второго порядка; α - и β -кварц, α - и β и γ -тридимит, α - и β -кристобалит. Все кристаллические формы SiО2, представленные на диаграмме, могут быть разделены на две группы. К первой группе относятся формы, имеющие при нормальном давлении (при котором и была построена диаграмма Феннера) температурные области стабильного существования (на диаграмме они отмечены сплошными линиями). К ним относятся β -кварц (устойчив до 575°С), α -кварц (575... 870°С), α -тридимит (870... 1470°С) и α -кристобалит (1470... 1728°С). Ко второй группе относятся формы, которые при нормальном давлении существуют только в метастабильном состоянии (пунктирные линии на диаграмме): γ -тридимит (ниже 120°), β -тридимит (120... 163°С) и β -кристобалит (ниже 230°С). Весьма важным для практики, например при производстве динасовых огнеупоров, являются изменения плотности и объема при полиморфных превращениях SiО2.При переходе от низкотемпературных форм Si02 к высокотемпературньм плотность уменьшается, а удельный объем увеличивается. Объемные изменения при фазовых переходах в системе Si02 (расширение при нагревании, сжатие при охлаждении) могут достигать весьма значительных величин (до 15%) и служить причиной разрушения изделий на основе Si02 (например, динасового кирпича). Из кварца при нагревании или из кварцевого стекла при охлаждении в качестве первичной фазы в широком интервале температур стремится выделиться кристобалит. Этот первично возникающий кристобалит называется метакристобалитом. Данный характер превращений соответствует правилу ступеней Оствальда, поскольку из всех кристаллических форм Si02 кристобалит в широком температурном интервале является наименее устойчивой формой Si02 (обладающей большей упругостью пара). Кроме указанных на диаграмме Феннера в настоящее время известно еще несколько метастабильных при обычных давлении и температуре форм кремнезема, к которым принадлежат полученные при высоких давлениях китит, коэсит и стишовит, а также волокнистый кремнезем. Китит получен в 1954 г. П. Китом гидротермальным синтезом из щелочных растворов кремниевой кислоты при температуре 380... 585°С и давлении 35...126 МПа. При прокаливании на воздухе при ~1600°С он переходит в кристобалит. В природе не обнаружен. Коэсит был получен в 1953 г. Л. Коэсом прокаливанием смеси метасиликата натрия с дифосфатом аммония при температуре 500... 800°С и давлении 3500 МПа в течение 15 ч. Эта разновидность кремнезема может быть получена и из других кремнеземсодержащих смесей при температуре > 800°С и давлении 3500... 13 500 МПа. Коэсит представляет собой прозрачную тонкозернистую разновидность Si02, обладающую по сравнению с кварцем повышенной плотностью (3, 01-103 кг/м3) и твердостью. Легко превращается в кварц при высоких температурах в области устойчивости последнего, при 1700°С переходит в кристобалит. Обнаружен в природе в метеоритных кратерах. Стишовит (стиповерит) впервые был получен в 1961 г. советскими учеными С. М. Стишовым и С. В. Поповой при температуре 1200... 1400°С и давлении > 1, 6-104МПа. Образуется из чистого кварца при указанных температурах в области давлений (1... 1, 8)-Ю4 МПа. Стишовит является наиболее плотной (4, 35-103 кг/м3) из известных разновидностей кристаллического Si02, от других форм Si02 отличается нерастворимостью в HF. Прокаливание стишовита при 900°С приводит к его превращению в кристобалит. Обнаружен в природе в метеоритных кратерах. Отдельной модификацией Si02 следует считать и волокнистый кремнезем (кремнезем W), синтезированный в 1954 г. при нагревании до температуры 1200... 1400°С стехиометрической смеси дисперсных SiО2 и Si в атмосфере чистого кислорода. Система Al2O3 Глинозем А12О3 может образовывать много полиморфных разновидностей. Кроме α -, β - и γ - А12О3 встречается указание на существование δ -, η -, θ -, Многие разновидности глинозема, например θ -,
А1(ОН)з→
Возможно, что некоторые из неустойчивых разновидностей глинозема могут существовать только будучи стабилизированными незначительными примесями посторонних оксидов. В настоящее время доказано, что β -А12О3 не является отдельной модификацией А12О3, а представляет собой гексагональные высокоглиноземистые соединения (алюминаты) глинозема с оксидами щелочных и щелочно-земельных металлов с общей формулой R2О-nA12О3 или RO- nA12О3, где R — соответственно щелочной и щелочно-земельный металл, а п может достигать 11... 12. Действительно доказанным можно считать лишь существование двух самостоятельных модификаций глинозема: α - и γ - A12О3. α -A12О3, встречающийся в природе в виде минерала корунда, представляет собой наиболее устойчивую в широком интервале температур разновидность глинозема. Корунд — конечный продукт термической обработки всех других разновидностей глинозема. Его можно получить прокаливанием гидратов или солей алюминия при температуре > 1000... 1200°С или плавлением при 2100... 2500°С технического глинозема γ - A12О3 или бокситов — природных пород, содержащих гидраргиллит, бемит, диаспор. γ - A12О3 (технический глинозем)—важная в практическом отношении искусственная форма глинозема, существующая в зависимости от способа получения в нескольких формах. Мелкодисперсная кубическая форма γ -глинозема образуется при прокаливании гидратных форм глинозема при температуре 600... 950°С. Особенностью этой формы является содержание в ней структурно связанной воды в количестве 1... 2%. Явно кристаллический (плотный) γ -глинозем образуется при охлаждении алюмосиликатных и алюмофосфатных расплавов, содержащих литий. Существуют сведения также о γ /-форме A12О3, образующейся на электродах при электролитическом получении алюминия, и некубической модификации γ -глинозема. Все указанные формы γ -глинозема при нагревании монотропно переходят в α -A12О3 (корунд). Точную температуру этого превращения указать трудно, поскольку она зависит от многих факторов, в частности от характера предшествующей термической обработки глинозема, наличия примесей и т. д. По-видимому, превращение γ -глинозема в α -A12О3 начинается уже при сравнительно низких температурах (~800°), однако происходит очень медленно и интенсифицируется только при температуре > 1000... 1200°С. По некоторым данным, повышенной устойчивостью обладает кристаллический (плотный) γ -глинозем, стабилизированный Li2О, который переходит в α -A12О3 лишь при температуре > 1600°С. Система А12О3 имеет существенное значение для технологии высокоогнеупорных, абразивных, химически стойких и других керамических материалов. В виде монокристаллов корунд находит применение в квантовых оптических генераторах, парамагнитных усилителях, квантовых счетчиках для регистрации инфракрасного излучения. Окись алюминия широко распространена в составе многих природных алюмосиликатах как водных так и безводных. В свободном состоянии встречается в природе в формах минерала корунда, представляющая наиболее устойчивую форму Кроме него были получены исключительно синтетическим путем еще 2 формы Твердость корунда по шкале твердости равна 9. Как природная так и плавленая окись алюминия используется для изготовления абразивных материалов. Высокая температура плавления корунда 20500С обуславливает применение его в огнеупорном деле в составе высокоогнеупорных материалов типа: динамидона, коракса. Весьма интересная отрасль химической технологии – это производство синтетических рубинов и сапфиров, представляющее собой драгоценные разновдности корунда, окрашенные примесями небольших количеств коси хром, железа и титана. Искусственные рубины вследствие своей высокой твердости применяются в качестве опорных камней в часовых механизмах и других точных измерительных приборах. Первоначально производство рубинов осуществлялось по методу разработанному Вернейлем.
|

 х-, ρ
х-, ρ 
 модификации Al2O3 .
модификации Al2O3 . Al2O3 .
Al2O3 .


