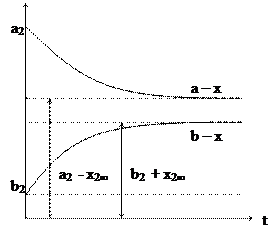Основные постулаты, используемые при исследовании кинетики сложных реакций
Для установления кинетических параметров сложных реакций одного основного постулата химической кинетики недостаточно, т.е. Существует три принципа, которыми необходимо пользоваться при рассмотрении сложных химических реакций: а) принцип независимости протекания простой химической реакции, т.е. любая реакция в составе сложной, протекает независимо, и к ней применим основной постулат химической кинетики; б) принцип лимитирующей стадии – если сложная реакция состоит из нескольких простых, то самая медленная простая реакция влияет на общую скорость сложной реакции, т.е. общая скорость процесса определяется скоростью самой медленной стадии, которая называется лимитирующей; в) третий принцип - принцип детального равновесия, т.е. если в составе сложной реакции имеются несколько обратимых, то в каждой из ее простых стадий сохраняется химическое равновесие, а в момент равновесия скорость прямой реакции становится равной скорости обратной.
Обратимые реакции Обратимыми называются реакции, которые идут одновременно в двух противоположных направлениях с участием одних и тех же частиц. Для обратимых реакций характерно, что они очень сильно зависят от внешних условий, т.е. температуры, давления, при этом они могут менять свое направление. Для обратимых реакций характерным фактором является то, что общая скорость в любой момент времени равна разности скоростей прямой и обратной реакций. К1 Рассмотрим кинетику обратимой реакции 1-го порядка: АÛ В, К2 где К1 и К2 - константы скоростей прямой и обратной реакций соответственно. Общая скорость для этой реакции будет равна:
Распишем для каждой реакции основной постулат химической кинетики, используя принцип независимости протекания химической реакции:
Пусть t=0, [cA]=a, [cB]=b, тогда при t> 0 [cA]=a-x, [cB]=b+x. Полученные выражения подставим в уравнение (1):
Решение этого уравнения позволяет найти основное соотношение для констант скоростей обратимой реакции первого порядка:
Для того, чтобы отдельно найти К1 и К2, надо рассматривать уравнение скорости в состоянии равновесия: а) б) в состоянии равновесия:
Для расчета констант скоростей обратимых реакций первого порядка применяют определенное сочетание вышеуказанных уравнений.
Кинетические кривые обратимых реакции первого порядка Кинетические кривые для обратимой реакции первого порядка при На рисунке 1а пунктирными линиями отражена зависимость в случае Для обратимых реакций первого порядка кинетические кривые зависят от значения константы равновесия. Если константа равновесия имеет большое значение, то ход кинетических кривых представлен на рисунке 1б, а если константа равновесия имеет малую величину, то график зависимости концентраций А и В имеют другой вид (рисунок 1в).
А б
В Рисунок 1 – Кинетические кривые обратимой реакции первого порядка
|


 .
. (1)
(1) ;
; 
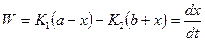 (2), где х - количество молей веществ А и В, которое вступило в реакцию к моменту времени t.
(2), где х - количество молей веществ А и В, которое вступило в реакцию к моменту времени t. (3), где
(3), где 
 /в состоянии равновесия х®х¥ /=
/в состоянии равновесия х®х¥ /=  или
или 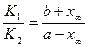 , а
, а 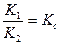 - константа равновесия.
- константа равновесия. . Решение этого уравнения позволяет найти:
. Решение этого уравнения позволяет найти: и
и 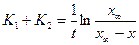 .
. , при
, при  и в общем виде представлены на рисунках 1а, 1б.
и в общем виде представлены на рисунках 1а, 1б.