Первый закон термодинамики
Первый закон термодинамики – это закон сохранения энергии в изолированной системе. Теплота Q, переданная системе, идёт на увеличение её внутренней энергии Δ U и на совершение работы системой против внешних сил: Q = Δ U + A (1) Для бесконечно малого изменения величин: δ Q = dU + δ A, (2) бесконечно малое изменение функций состояния принято обозначать буквой d, а функций процесса – δ. Внутренняя энергия - это общий запас энергии системы. Она включает в себя все виды энергии системы (энергию движения и взаимодействия молекул, атомов, ядер и др. частиц, внутриядерную и др. виды энергии), кроме кинетической энергии движения системы, как целого, и потенциальной энергии её положения. Абсолютную величину внутренней энергии измерить нельзя, можно определить её изменение при переходе системы из начального состояния в конечное. Внутренняя энергия представляет собой способность системы к совершению работы или передачи тепла.
При увеличении внутренней энергии Δ U> 0, при уменьшении Δ U< 0. Работа процесса – это энергия, передаваемая одним телом другому при их взаимодействии. В химической термодинамике обычно рассматривают работу расширения газа А = р · Δ V. Если система совершает работу, то величина А положительна, так как Δ V = Поскольку работа является функцией процесса, то её изменение
Для изохорных процессов, т.е. процессов, протекающих при постоянном объёме (V=const, dV=0): δ Qv = dU, Qv = Δ U. (5) Для изобарных процессов, протекающих при постоянном давлении (p=const, dp=0), выражение первого закона термодинамики можно преобразовать, если использовать функцию состояния системы, называемую энтальпией. Энтальпия H, как и внутренняя энергия, не зависит от пути процесса, характеризует полную энергию системы и «теплосодержание»: H = U + pV; dH = dU + d(pV) = dU + pdV + Vdp; (6) при р=const, dp=0, Vdp=0 δ Qp = dU + pdV = (dH – pdV) + pdV = dH, Qp = Δ H (7) Для изотермических процессов, протекающих при постоянной температуре (T = const и U = const, dU = 0) δ Q = δ A, Q = A. (8) Для адиабатных процессов, при которых нет теплообмена системы с окружающей средой (δ Q = 0):
δ A = - dU, A = - Δ U. (9)
|

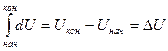 (3)
(3)
 (4)
(4)


