Второй закон термодинамики
Второй закон термодинамики устанавливает критерии, позволяющие определить направление самопроизвольного протекания процессов. Самопроизвольными называют процессы, которые протекают в системе без затраты энергии извне. Процессы бывают обратимыми и необратимыми. Необратимые процессы идут самопроизвольно лишь в одном направлении. После протекания данных процессов, сопровождающихся изменениями в системе и окружающей среде, невозможно вернуть одновременно и систему и окружающую среду в исходное состояние. Обратимыми являются процессы, после которых систему и окружающую среду можно вернуть в исходное состояние. Второй закон термодинамики имеет несколько формулировок, в варианте, предложенном Клаузиусом, он выглядит следующим образом: невозможен самопроизвольный переход теплоты от холодного тела к горячему. Физический смысл второго закона термодинамики заключается в том, что любой самопроизвольный процесс протекает в направлении, при котором система из менее вероятного состояния переходит в более вероятное состояние. Другими словами, самопроизвольному протеканию процесса способствует увеличение неупорядоченности в системе. Для характеристики меры неупорядоченности используется термодинамическая функция – энтропия S, которая связана с термодинамической вероятностью системы формулой Больцмана: S = k · lnW, (25) где k – постоянная Больцмана. Под термодинамической вероятностью W понимают число равновероятных микроскопических состояний, которыми может быть реализовано данное макроскопическое состояние системы. Для определения термодинамической вероятности системы необходимо найти число различных вариантов положений всех частиц системы в пространстве. Энтропия является количественной мерой беспорядка в системе. Чем больше W, тем хаотичнее система, тем больше величина энтропии. Нагревание вещества приводит к увеличению энтропии, а охлаждение – к уменьшению. При приближении к абсолютному нулю (-273º С) энтропия стремится к нулю, что позволяет определить абсолютные значения энтропии различных веществ, значения которых при стандартных условиях представлены в таблицах. Следует отметить, что в отличие от энтальпии образования, энтропия простого вещества, даже находящегося в кристаллическом состоянии, не равна нулю, т.к. при температуре, отличающейся от абсолютного нуля, макросостояние кристалла может быть реализовано не единственным макросостоянием, а большим числом равновероятных состояний. Другая формулировка второго закона термодинамики выглядит так: полная энтропия всегда увеличивается в самопроизвольном процессе. Увеличение энтропии Δ S при протекании процесса должно превышать или быть равным отношению количества теплоты Q, переданного системе, к температуре Т, при которой теплота передаётся:
Уравнение (26) является математической записью второго начала термодинамики. В данном уравнении знак неравенства относится к необратимым самопроизвольным процессам, а знак равенства – к обратимым процессам. Согласно уравнению (26), изменение энтропии при обратимом переходе системы из состояния 1 в состояние 2 можно определить как: Δ S = S2 – S1 = Фазовые переходы сопровождаются тепловым эффектом, называемым теплотой фазового перехода Δ Нф.п., и являются изотермическими процессами (Тф.п.= const). Для фазового перехода одного моля вещества изменение энтропии равно: Δ Sф.п.= В процессах плавления, испарения жидкости или сублимации вещества энтропия увеличивается, так как разрушается упорядоченная кристаллическая решётка. Обратные процессы: кристаллизации, конденсации, десублимации сопровождаются уменьшением неупорядоченности в системе, и следовательно, уменьшением энтропии. При изменении температуры вещества от Т1 до Т2 при постоянном давлении изменение энтропии определяется по формуле: Δ S = поскольку Ср = const, то Δ S = Ср· ln Для изохорных процессов Δ S = при Сv = const Δ S = Сv· ln Стандартной энтропией Δ S Δ S Наиболее хаотичной формой вещества является газообразное состояние, поэтому если в результате химической реакции число молей газа увеличивается, то хаотичность, а следовательно, и энтропия системы возрастает. Обычно определяют не абсолютн6ое значение энтропии, а её изменение (S2 – S1) в том или ином процессе. Для вычисления изменения энтропии при переходе одного моля идеального газа из одного состояния в другое используют формулы: S2 – S1 = R S2 – S1 = R где Ср и Сv – постоянные величины. Изменение энтропии при нагревании единицы массы вещества, находящегося в твёрдом или жидком состоянии, рассчитывают по формуле: S2 – S1 = где При переходе вещества из одного агрегатного состояния в другое изменение энтропии определяется по формуле: S2 – S1 = где L – скрытая теплота обратимого фазового перехода (испарения, плавления и др.); Т – температура фазового перехода.
|


 . (26)
. (26) . (27)
. (27) . (28)
. (28) , (29)
, (29) . (30)
. (30) , (31)
, (31)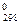 называется энтропия 1 моля вещества в стандартных условиях. Изменение стандартной энтропии Δ S
называется энтропия 1 моля вещества в стандартных условиях. Изменение стандартной энтропии Δ S 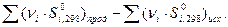 (33)
(33) (34)
(34) (35),
(35),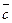 ln
ln 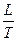 (37),
(37),


