Идеальный газ
Характерными свойствами любого газа являются стремление занять как можно больший объём и сильная зависимость объёма от давления и температуры. Исходя из внешних признаков, газ – это такое состояние вещества, в котором вещество не имеет ни собственного определённого объёма, ни определённой формы. Экспериментальным путём установлено, что объём любого газа зависит от трёх параметров: температуры – Т, давления – Р, числа молекул – N. Существуют законы, описывающие зависимость объёма от каждого из трёх параметров при постоянстве двух других: 1. Закон Бойля-Мариотта: при постоянной температуре объём данной массы газа обратно пропорционален давлению: РV = const (T, N – const) (51) При постоянной температуре объёмы данной массы газа обратно пропорциональны давлениям, под которыми находится газ:
Плотности газа ρ и его концентрация С при постоянной температуре прямо пропорциональны давлениям:
2. Законы Гей-Люссака – Шарля: при постоянном давлении объём данной массы газа прямо пропорционален абсолютной температуре: V/T = const (P, N – const). (55) При постоянном объёме давления данной массы газа прямо пропорциональны абсолютным температурам:
Плотности и концентрации газа, находящегося под постоянным давлением, изменяются обратно пропорционально абсолютным температурам:
Зависимость между объёмами, давлениями и температурами для одной и той же массы газа выражается уравнением, объединяющим законы Бойля – Мариотта, Шарля и Гей – Люссака:
где V1 – объём газа при температуре Т1 и давлении Р1; V2 – объём газа при температуре Т2 и давлении Р2 и т.д. 3. Закон Авогадро: при постоянных температуре и давлении в равных объёмах газов содержится одинаковое число молекул V/N = const (P, T – const) Из закона Авогадро вытекает важное следствие: при одинаковых условиях молярные объёмы всех газов одинаковы. При нормальных условиях ( Р=1атм) молярный объём газа V0=22, 4 л.
|

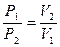 (52)
(52) , (53)
, (53) . (54)
. (54) . (56)
. (56) , (57)
, (57) . (58)
. (58) , (59)
, (59)


