501-505. Дана схема гальванического элемента. Напишите электронные уравнения электродных процессов и уравнение токообразующей реакции, протекающих в этом элементе. Рассчитайте изменение энергии Гиббса в токообразующей реакции, используя стандартные значения для соответствующих ионов в водных растворах (прил. 5). Рассчитайте стандартное значение ЭДС (ε) элемента по формуле  =
= 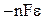 :
:
| Задачи
| Схема гальванического элемента
|
|
| (-) Сr/Сr2(SО4)3//Со(NO3)2/Со(+)
|
|
| (-) Fе/FеС12//NiSО4 /Ni (+)
|
|
| (-) Mn/MnС12//Рb(NО3)2/Рb (+)
|
|
| (-) Zn/Zn(NO3)2 //AgNO3/Ag (+)
|
|
| (-)Аl/АlС13 //Cu(NO3)2 /Cu (+)
|
506-510. Определите константу равновесия токообразующей реакции,
протекающей в гальваническом элементе, используя стандартное значение
ЭДС, и учитывая, что lgK = ε ·n/0, 059:
| Задачи
| Схема гальванического элемента
|
|
| (-) Сr/Сr2(SО4)3//Со(NO3)2/Со(+)
|
|
| (-) Fе/FеС12//NiSО4 /Ni (+)
|
|
| (-) Аl/АlС13//OsCl2/Os (+)
|
|
| (-) Th/Th(SО4)2//СdSО4/Сd (+)
|
|
| (-) Cr/ CrCl3 // CuSO4/Cu (+)
|
511-515. Через раствор А пропускают ток силой I ампер в течение t мин. Используя только закон Фарадея, определите объемы продуктов, выделившихся на платиновых электродах, а также массу разложившейся воды. Выход по току для катодного и анодного процессов принять равным 100%. Приведите уравнения реакций.
| Задачи
|
|
|
|
|
|
| А
| Li2SO4
| NaCl
| KCl
| KOH
| NaOH
|
| t, мин
|
|
|
|
|
|
| m, г
|
|
|
|
|
|
516-520. Установите последовательностьэлектродных процессов, протекающих на графитовых электродах при электролизе раствора соли А, содержащего по 0, 1 моль/л указанных солей, и составьтеуравнения электродных реакций. Какие вещества и в каком количестве выделятся на катоде, если раствор соли А подвергается электролизу в течение t, мин при силе тока I.
| Задачи
|
|
|
|
|
|
| А
| CuSO4
| AgNO3
| FeSO4
| CoCl2
| SnSO4
|
|
| CdSO4
| Bi(NO 3)3
| ZnSO4
| ZnCl2
| CdSO4
|
| t, мин
|
|
|
|
|
|
| I, А
|
|
|
|
|
|

 =
= 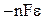 :
:


