ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. Окислительно-восстановительными называются реакции, которые сопровождаются изменением степени окисления атомов
Окислительно-восстановительными называются реакции, которые сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ. Степень окисления – это условный заряд атома в молекуле, возникающий вследствие разности электроотрицательностей и рассчитанный из предположения, что молекула состоит только из ионов. Окисление – это процесс отдачи электронов, который приводит к повышению степени окисления восстановителя. Восстановление – это процесс присоединения электронов, при котором понижается степень окисления у окислителя. При определении степени окисления атомов необходимо помнить: - что степень окисления атома в молекуле простого вещества равна нулю; - степень окисления атома водорода во всех соединениях, кроме гидридов щелочных и щелочноземельных металлов равна +1; - степень окисления кислорода во всех соединениях, кроме пероксидных и ОF2, равна –2; - сумма степеней окисления всех атомов в молекуле равна нулю. Атом элемента в высшей степени окисления является только окислителем (например, сера в молекуле H2SO4 имеет высшую степень окисления 6+); атом элемента в низшей степени окисления является только восстановителем (например, сера в молекуле H2S имеет низшую степень окисления 2–); атом элемента, находящийся в промежуточной степени окисления, может быть и окислителем и восстановителем (например, сера в молекуле H2SO3 имеет промежуточную степень окисления 4–). Такие соединения проявляют окислительно-восстановительную двойственность и способны к реакциям диспропорционирования. Пример 1. Могут ли происходить окислительно-восстановительные реакции между веществами: а) H2S и HI; б) H2S и H2SО3; в) H2SО3 и HClО4? Решение: а) степень окисления серы в H2S равна –2, йода в HI равна –1. Так как и сера, и йод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут; б) степень окисления серы в H2S равна –2, то есть низшая, в H2SО3 –равна +4 – промежуточная. Следовательно, взаимодействие этих веществ возможно, причем H2SО3 является окислителем; в) степень окисления серы в H2SО3равна +4 (промежуточная), хлора в HClО4 равна +7 (высшая). Соединения H2SО3 и HClО4 могут реагировать, причем H2SО 3 будет проявлять восстановительные свойства. Пример 2. Завершить уравнение реакции, дописав недостающие продукты. Составить уравнения полуреакций окисления и восстановления, на их основе написать уравнения реакций в ионной и молекулярной формах: KNO2+KI+H2SO4®J2+NO + …` Решение. В реакции йод меняет степень окисления от –1 в иодиде калия до нуля в I2. Йод теряет электроны, т.е. окисляется. Восстанавливаться в данной реакции будет азот, который меняет степень окисления от +3 до +2. Нитрит-ион восстанавливается до NO с приобретением одного электрона на каждый атом азота. Избыточный кислород нитрит-иона будет связываться водородными ионами кислой среды с образованием воды:
Полученное уравнение является уравнением искомой реакции в ионной форме. Молекулярное уравнение реакции получится, если учесть, что ионы калия, освобождающиеся при разрушении молекул KNO2 и KJ, образуют соли с серной кислотой: 2KNO2+2KI+2H2SO4®J2+2NO +2 К2SO4+2 H2O Пример 3. Установить, в каком направлении возможно самопроизвольное протекание реакции 2NaCl+Fe2(SO4)3=2FeSO4+Cl2+Na2SO4? Решение. Уравнение реакции в ионно-молекулярной форме: 2Cl-+2Fe3+=2Fe2++Cl2 Запишем стандартные электродные потенциалы электрохимических систем, участвующих в реакции, используя данные прил. 6: Cl2+2e-=2Cl- E1=1, 36 B Fe3++e-=Fe2+ E2=0, 77 B Поскольку Е1 > Е2, то окислителем будет служить хлор, а восстановителем – ион Fe2+; рассматриваемая реакция будет протекать справа налево.
Пример 4. Найти при 25°С константу равновесия реакции Hg2(NO3)2+2Fe(NO3)2=2Hg+2Fe(NO3)3. Решение. Уравнение реакции в ионно-молекулярной форме:
Hg22++2e-=2Hg+2Fe3+
В реакции участвуют две электрохимические системы (прил. 6): Hg22++2e-=2Hg - E1=0, 79 В Fe3++e-=Fe2+ E2=0, 77 B
Находим значение стандартной ЭДС рассматриваемого элемента:
E0=E1-E2=0, 79-0, 77=0, 02 В.
Теперь вычислим константу равновесия реакции:
Ответ: К=4, 76.
|



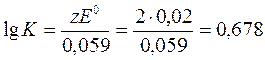 , К=4, 76.
, К=4, 76.


