Изобара реакции
Производная ln K 0 по температуре при постоянном давлении равна:
Данное уравнение называется изобарой реакции. На практике для приближенных расчетов можно считать, что D rН 0 T»D rН 0298, тогда
Если известен знак теплового эффекта реакции, то, согласно изобаре реакции, можно качественно определить «направление сдвига равновесия» при изменении температуры реакционной смеси. Под сдвигом равновесия подразумевается следующее. При равновесии в замкнутой системе устанавливаются равновесные концентрации реагирующих веществ. Если в системе изменяется одно из условий равновесия (температура, давление, количество взаимодействующих веществ), то система переходит в другое состояние равновесия с новыми равновесными концентрациями. Если в результате перехода новые равновесные концентрации продуктов реакции увеличиваются, то говорят о сдвиге равновесия в прямом направлении (вправо), если увеличиваются равновесные концентрации исходных веществ, то это сдвиг равновесия в обратном направлении (влево). Анализ уравнения изобары. Пусть в системе протекает реакция n аA + n bB Û n сC + n dD:
Поскольку температура и универсальная газовая постоянная – величины положительные, то знак производной функции ln K 0(T)определяется знаком теплового эффекта реакции. 1. Экзотермическая реакция – D rН 0< 0. Поскольку производная 2. Эндотермическая реакция – D rН 0> 0. Производная
|

 .
. .
. ,
, 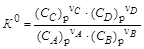 .
.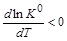 , то функция K (T) убывающая, т. е. с увеличением температуры константа равновесия уменьшается. Следовательно, при возрастании температуры равновесие сдвигается в обратном направлении (уменьшение константы равновесия требует уменьшения числителя и соответственно увеличения знаменателя).
, то функция K (T) убывающая, т. е. с увеличением температуры константа равновесия уменьшается. Следовательно, при возрастании температуры равновесие сдвигается в обратном направлении (уменьшение константы равновесия требует уменьшения числителя и соответственно увеличения знаменателя).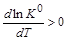 , следовательно, функция K (T) возрастающая, т. е. с увеличением температуры константа равновесия увеличивается. При этом равновесие сдвигается в прямом направлении (увеличение константы равновесия требует увеличения числителя и уменьшения знаменателя).
, следовательно, функция K (T) возрастающая, т. е. с увеличением температуры константа равновесия увеличивается. При этом равновесие сдвигается в прямом направлении (увеличение константы равновесия требует увеличения числителя и уменьшения знаменателя).


