Расчет равновесного состава газовой смеси
При протекании гомогенной обратимой реакции в газовой фазе после установления химического равновесия в системе будут присутствовать как продукты реакции, так и исходные вещества. Зная уравнение химической реакции, величину константы равновесия и начальные концентрации реагентов, можно рассчитать равновесные концентрации всех веществ. Их величины будут зависеть от температуры и давления. Необходимо отметить, что в достаточно широкой области давлений и температур газовые смеси можно считать идеальными и проводить расчеты равновесного состава газовой смеси, считая коэффициент фугитивности g i @ 1. Реакции в газовой фазе протекают в относительно широком интервале температур и давлений. Константы равновесия для каждой конкретной реакции, как правило, рассчитываются с использованием табличных значений термодинамических функций реагирующих веществ для определенных температури давлений. Пусть протекает обратимая газовая реакция n AA + n BB Û n DD + n EE. С использованием термодинамических характеристик реакции (D rG 0(T), D rH 0(T), D rS 0(T)) рассчитывается стандартная константа равновесия К 0 (Т) для определенной температуры Т:
Из стандартной константы равновесия К 0(Т) рассчитывают константы равновесия КX (Т, p) и Кр (Т). Отметим, что величина КX (Т, p) зависит от давления, а Кр (Т) не зависит:
где р 0 = 1, 013× 105 Па – стандартное давление; Dn= (n D + n E)–(n A + n B) –изменение числа молей в ходе реакции. Расчет равновесного состава продуктов реакции для изобарного процесса проводят с использованием мольных долей (Xi) и соответственно КX, а для изохорного процесса с использованием парциальных давлений реагентов (рi) и соответственно Кр. Рассмотрим расчет равновесного состава продуктов реакции, протекающей при постоянном давлении. Пусть в начальный момент времени в системе содержится соответственно nA, nB, nD, nE молей реагентов и к моменту наступления равновесия прореагирует x молей вещества А. Тогда в результате реакции число молей исходных веществ и продуктов изменится и станет равным соответственно nA- x, nB- Мольная доля i -го вещества в равновесной смеси равна:
где S ni – суммарное число молей всех веществ в системе в состоянии равновесия, S ni =(nA- x) + (nB- Константа равновесия данной реакции
Подставив в константу равновесия соответствующие выражения для мольных долей реагентов, получим уравнение с одним неизвестным x. Его решение позволяет рассчитать равновесный состав газовой смеси.
|

 .
.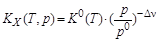 ,
,  ,
, , nD+
, nD+ 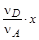 , nE+
, nE+  .
. ,
,



