Изотерма реакции
Если система не находится в состоянии равновесия (D rGT ¹ 0), то концентрации реагирующих веществ отличны от равновесных. В этом случае, если в системе протекает реакция n аA + n bB Û n сC + n dD, изменение энергии Гиббса реакции равно: D rGT =D rG 0 T + R × T ×
D rGT =D rG 0 T + R × T ln KТ× ¹ 0, где Поскольку D rG 0 T + R × T × ln K 0=0 ® D rG 0 T = – R × T × ln K 0, где Это уравнение называется изотермой реакции. С его помощью можно определить направление протекания химической реакции при постоянной температуре в зависимости от соотношения концентраций реагентов.
|

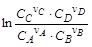 ¹ 0,
¹ 0, – выражение, построенное по типу константы равновесия, содержащее концентрации реагирующих веществ в системе, не находящейся в состоянии равновесия. Эти концентрации в начальный момент времени являются произвольными и в ходе реакции изменяются до равновесных значений.
– выражение, построенное по типу константы равновесия, содержащее концентрации реагирующих веществ в системе, не находящейся в состоянии равновесия. Эти концентрации в начальный момент времени являются произвольными и в ходе реакции изменяются до равновесных значений. – константа равновесия, то D rGT = R × T (ln KТ – ln K 0).
– константа равновесия, то D rGT = R × T (ln KТ – ln K 0).


