Обменные реакции с образованием осадка
Если в растворе находятся ионы, которые могут образовать малорастворимое соединение, то равновесие смещается в сторону образования осадка. Динамическое гетерогенное равновесие, установившееся между веществом, находящимся в растворе в виде ионов и его осадком, описывается уравнением Kat x An y Û x Kat+ + y An- осадок Û раствор Константа гетерогенного равновесия в данном случае называется произведением растворимости – ПР (произносится «пэ эр»):
Величины произведения растворимости приводятся в справочной литературе. Зная величину ПР малорастворимого соединения, можно вычислить его растворимость. Поскольку соли при растворении в воде полностью диссоциациируют на ионы, то из каждой молекулы образуется x катионов и y анионов. Следовательно, в растворе соли концентрации C [моль/л] концентрации катионов и анионов составят величины: [Kat+] = x × C, [An-] = y × C. Подставив их в выражение ПР, получим
Используя справочные значения ПР, можно вычислить молярную концентрацию соли C в растворе. Пример. Определить растворимость иодида свинца в г/л и концентрацию ионов свинца и иода. ПРРbI2= 8, 1× 10-9: РbI2 Û Рb+2 + 2 I-, ПР = [Рb+2] × [I-]2. Обозначим концентрацию РbI2 в растворе C. Тогда, согласно уравнению диссоциации, концентрации ионов равны: [Рb+2] = C, [I-] = 2 × C. Подставив их в уравнение произведения растворимости, можно вычислить концентрацию РbI2 и концентрации ионов: ПР= C× (2 × C)2 [Рb+2] = C = 1, 26× 10-3моль/л, [I-] = 2× C = 2, 52× 10-3моль/л. Растворимость иодида свинца в г/л равна: S = C × М, где M = 461г/моль – молярная масса РbI2: S = 1, 26× 10-3× 461 = 0, 54 [г/л].
|

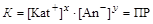 .
. ,
,  [моль/л].
[моль/л]. ,
,


