Растворы кислот и оснований
При диссоциации кислот или оснований устанавливаются равновесия: HAn Û H+ + An-, KatOH Û Kat+ + OH-, где Kat+ - катион; An- - анион. Процессу диссоциации соответствуют константы равновесия для кислот Ka (acid – кислота), а для оснований Kb (base – основание):
Величины констант диссоциации приводятся в справочной литературе. Для слабых электролитов (a®0) концентрация вещества в недиссоциированной форме примерно равна общей концентрации растворенного вещества. Согласно уравнению диссоциации концентрации катионов и анионов равны: [H+]= [An-]; [Kat+] = [OH-] (в результате единичного акта диссоциации получается один катион и один анион). Тогда константы диссоциации соответственно равны:
Из уравнений следует, что
Соответственно раствор кислоты концентрацией С кисл моль/л имеет
а раствор основания концентрацией С осн моль/л
Концентрация ионов водорода и соответственно рН сильных кислот и оснований (a®1) рассчитывается, как правило, через степень диссоциации. Концентрации ионов водорода будут соответственно равны: в растворе кислоты [H+] = a× C кисл, в растворе щелочи [OH–] = a× C осн [H+]= =10–14/[OH–]. Таким образом, раствор кислоты концентрацией С кисл моль/л имеет рН = –lg[a× С кисл], а раствор основания концентрацией С осн моль/л pH = 14 + lg[a× C осн]. Многоосновные кислоты и основания диссоциируют ступенчато, причем константа диссоциации каждой последующей ступени на несколько порядков меньше предыдущей. Поэтому часто расчет рН проводят по первой ступени диссоциации.
|

 ,
, 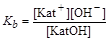 .
. ,
, 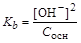 .
. ,
, 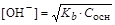 .
. ,
, .
.


