Гидролиз солей. Водные растворы солей являются электролитами, в которых молекулы соли практически полностью диссоциированы на ионы:
Водные растворы солей являются электролитами, в которых молекулы соли практически полностью диссоциированы на ионы: KatAn ® Kat+ + An-. Катионы и анионы соли будут вступать во взаимодействие с ионами H+ и OH-, образовавшимися при диссоциации воды. Система придет в равновесие в результате установления равновесия в каждой реакции, которым будут соответствовать свои константы равновесия: H+ + An-Û HАn Kat+ + OH-Û KatOH H2O Û H+ + OH- KW. В зависимости от величин констант диссоциации кислоты (Ка) и основания (Кb) равновесие в растворе будет смещено либо в сторону образования молекул кислот и оснований, либо в сторону образования ионов. Таким образом, если соль образована катионом слабого основания или анионом слабой кислоты, то суммарные уравнения реакций могут быть записаны в виде Kat+ + H2O Û KatOH + H+ An- + H2O Û HAn + OH- Реакции такого типа называются реакциями гидролиза солей. Им соответствуют константы равновесия (К г), которые называются константами гидролиза. Гидролиз приводит к изменению химического состава раствора. В нем, кроме катионов и анионов соли, будут присутствовать молекулы слабых кислот и оснований. Гидролиз солей образованных многоосновными кислотами или основаниями протекает ступенчато. В этом случае в растворе будут присутствовать также гидроанионы или гидроксокатионы. Константы гидролиза каждой последующей ступени будут много меньше, чем предыдущей. Поэтому, как правило, описание гидролиза можно ограничить первой ступенью. Аналогично степени диссоциации используют понятие " степень гидролиза" как доли количества молекул соли, подвергшихся гидролизу. Как и степень диссоциации, степень гидролиза растет при уменьшении концентрации соли. Гидролизу подвержены все соли, образованные с участием ионов слабых электролитов. В большей степени гидролизуются соли, образованные одновременно катионом слабого основания и анионом слабой кислоты. Так же ему способствует вывод из реакционного объема продуктов (образование газа или осадка). Как видно из приведенных уравнений, гидролиз изменяет рН раствора. Раствор соли, образованной катионом слабого основания и анионом сильной кислоты, в результате гидролиза приобретает кислый характер среды (pH < 7). В случае катиона сильного основания и аниона слабой кислоты раствор соли имеет щелочной характер (pH > 7).
|

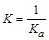 ,
, ,
, ,
, .
.


