Кипение и кристаллизация растворов
Кипение жидкости наступает, когда давление насыщенных паров становится равным внешнему давлению. Растворенное вещество понижает давление насыщенного пара растворителя над раствором. Это приводит к повышению температуры кипения раствора по сравнению с чистым растворителем. Величина изменения температуры кипения зависит только от концентрации частиц растворенного вещества, и не зависит от их природы. На диаграмме состояния (рис.3.4) для раствора концентрации С понижению давления насыщенных паров на величину D р соответствует повышение температуры кипения D Т кип при р 0 = 1, 013× 105 Па. Повышение температуры кипения раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества: D Т кип= K эб× С м, где D Т кип – повышение температуры кипения раствора по сравнению с чистым растворителем; См – моляльная концентрация растворенного вещества (число молей растворенного вещества, содержащихся в 1 кг растворителя); K эб – эбуллиоскопическая постоянная растворителя. Она характеризует растворитель и не зависит от природы растворенного вещества. Эбуллиоскопическую постоянную растворителя можно вычислить, зная его температуру кипения (T кип, К) и энтальпию парообразования (D vH, Дж/кг):
R – универсальная газовая постоянная; М – молярная масса растворителя. Кристаллизация раствора происходит при температуре более низкой, чем температура кристаллизации чистого растворителя. Это вызвано взаимодействием частиц растворенного вещества с молекулами растворителя, которое препятствует образованию кристаллической структуры. На диаграмме состояния (см. рис.3.4) понижение температуры кристаллизации D Т кр соответствует расстоянию между кривыми 2¢ и 2, измеренному по изобаре р 0 = 1, 013× 105 Па. Понижение температуры кристаллизации раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества: D Т кр= K кр× С м, где D Т кр– понижение температуры кристаллизации раствора по сравнению с чистым растворителем; K кр – криоскопическая постоянная растворителя. Она характеризует растворитель и не зависит от природы растворенного вещества. Криоскопическую постоянную растворителя можно вычислить, зная температуру кристаллизации растворителя (T кр, К) и энтальпию плавления ( D mH, Дж/кг):
Эбуллиоскопические и криоскопические постоянные некоторых растворителей:
Свойства растворов, зависящие от числа частиц растворенного вещества, а не от их химической природы, в частности повышение температуры кипения и понижение температуры кристаллизации, получили название коллигативных свойств. В растворе электролита за счет диссоциации увеличивается число частиц по сравнению с раствором неэлектролита той же концентрации. Это должно отразиться на коллигативных свойствах растворов электролитов. Следовательно, повышение температуры кипения и понижение температуры кристаллизации растворов будет зависеть не только от концентрации, но и от степени диссоциации растворенного вещества. Кроме того, при диссоциации молекулы в зависимости от ее химического состава образуется различное количество ионов. Увеличение числа частиц в растворе электролита характеризует изотонический коэффициент (i). Если при растворении вещества Kat x An y устанавливается динамическое равновесие: Kat x An y Û x Kat+ + y An-, то изотонический коэффициент равен отношению суммарного числа частиц (ионов и недиссоциированных молекул) в растворе к числу растворенных молекул:
где N 0– число молекул растворенного вещества; S(Ni) – суммарное число катионов, анионов и недиссоциированных молекул растворенного вещества. Если степень диссоциации вещества равна a, то с учетом уравнения диссоциации изотонический коэффициент
i =a× (m –1) + 1, где x – число катионов, y – число анионов, m = x + y – суммарное число частиц, образующихся в результате единичного акта диссоциации. В случае сильного электролита (a®1) все растворенные молекулы распадаются на ионы и изотонический коэффициент равен i = m.
|

 ,
, .
.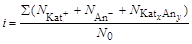 ,
, ,
,


