Задание. Для элементов цезий, железо и теллур ответить на вопросы:
1. Напишите электронные формулы атомов и их ионов в соответствии с правилом Клечковского.
2. Определите для каждого атома число протонов, электронов, нейтронов.
3. Определите число энергетических уровней у каждого атома.
4. Определите, в какой группе и подгруппе (главной – А или побочной - В) находится каждый атом.
5. К какому семейству элементов принадлежит каждый атом.
6. Напишите сокращенные электронные формулы для внешних и валентных электронов данных атомов.
7. Изобразите электронно-графические формулы валентных электронов данных атомов и определите значения всех квантовых чисел этих электронов.
8. Определите суммарный спин электронов подуровня, заполняющегося последним.
9. Определите число спаренных и неспаренных валентных электронов данных атомов в нормальном состоянии.
10. Определите число свободных и занятых атомных орбиталей на последнем уровне данных атомов в нормальном состоянии.
11. Напишите сокращенные электронные и электронно-графические формулы для всех возможных возбужденных состояний данных атомов.
Решение (пожалуйста, извините за опечатки).
| Cs (цезий)
| Fe (железо)
| Te (теллур)
|
| 1. Электронные формулы в соответствии с правилом Клечковского.
|

 металл
металл
|  металл
металл
| 
 неметалл
неметалл
|
| Металлы образуют простые ионы-катионы, отдавая валентные электроны, сначала с p-подуровня, затем с s-подуровня последнего уровня, а затем, для d-элементов, и с предпоследнего d-подуровня.
| Неметаллы образуют простые ионы-анионы, принимая электронына p-подуровень последнего уровня (максимально, чтобы на подуровне стало 6  ). ).
|
 (катион) (катион)


|  (катион) (катион)

 (катион) (катион)

|  (анион) (анион)


|
2. Число протонов (р) = номеру порядковому в таблице Менделеева
Число электронов в атоме ( = числу протонов
Число нейтронов (n) = атомная масса – число протонов = числу протонов
Число нейтронов (n) = атомная масса – число протонов
|



| 
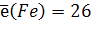

| 


|
| 3.Число энергетических уровней в атоме равно номеру периода, в котором расположен элемент в таблице
Менделеева:
|

| 
| 
|
| 4. По таблице Менделеева:
Cs – I группа Аподгр (главная)
| 4. По таблице Менделеева:
Fe – VIII группа Bподгр (побочная)
| 4. По таблице Менделеева:
Te – VI группа Аподгр (главная)
|
| 5. Семейство s-элементов, т.к. последним заполняется
s- подуровень (6s)
| 5. Семейство d-элементов, т.к. последним заполняется d-подуровень (3d)
| 5. Семейство p-элементов, т.к. последним заполняется p-подуровень (5p)
|
| 6. Внешние электроны – это электроны, находящиеся на внешнем (последнем) уровне:
|
| Внешние электроны атома цезия:
6s1
Валентные электроны для S-элементов соответствуют внешним электронам: 6s1
| Внешние электроны атома железа: 4s2
Валентные электроны для d-элементов - это электроны последнего S-подуровня и электроны d-подуровня предпоследнего уровня:
4s23d6
| Внешние электроны атома теллура: 5s25p4
Валентные электроны для p-элементов соответствуют внешним электронам:
5s25p4
|

| 
| 
|
7. Для каждого  должно быть четыре квантовых числа:
1) n – главное, оно соответствует (равно) номеру уровня, на котором находится должно быть четыре квантовых числа:
1) n – главное, оно соответствует (равно) номеру уровня, на котором находится  2) l – побочное (орбитальное), оно соответствует (равно) номеру подуровня, на котором находится
2) l – побочное (орбитальное), оно соответствует (равно) номеру подуровня, на котором находится  ,
если s-подуровень, то l =0
p-подуровень, то l =1
d-подуровень, то l =2
3) m e – магнитное, оно соответствует (равно) номеру орбитали, на которой находится ,
если s-подуровень, то l =0
p-подуровень, то l =1
d-подуровень, то l =2
3) m e – магнитное, оно соответствует (равно) номеру орбитали, на которой находится  :
s-подуровень имеет одну орбиталь: m e =0
p-подуровень имеет три орбитали: m e = -1, 0, 1 :
s-подуровень имеет одну орбиталь: m e =0
p-подуровень имеет три орбитали: m e = -1, 0, 1
 d-подуровня имеет пять орбиталей: m e = -2, -1, 0, 1, 2
d-подуровня имеет пять орбиталей: m e = -2, -1, 0, 1, 2
 4) ms – спиновое квантовое число может принимать только два значения: если ↑, то ms =
4) ms – спиновое квантовое число может принимать только два значения: если ↑, то ms =  , если ↓, то ms = , если ↓, то ms = 
|
7. Квантовые числа для валентных электронов атомов цезия:

| 7. Квантовые числа для валентных электронов атомов железа:
(вместо 6s2 следует записать 4s2)

| 7.Квантовые числа для валентных электронов атомов теллура:
(вместо цифр 4 и 3 следует записать 5, а вместо цифры 2 записать 1)

|
8. Суммарный спин – это сумма значений ms (всех  ) на подуровне, взятое по абсолютной величине (по модулю) ) на подуровне, взятое по абсолютной величине (по модулю)
|
последний подуровень в атоме цезия:
 суммарный спин:
суммарный спин:

| последний подуровень в атоме железа:
 суммарный спин:
суммарный спин:

| последний подуровень в атоме теллура:
 суммарный спин:
суммарный спин:

|
9. валентные  у атома цезия: у атома цезия:
 1 неспаренный электрон
1 неспаренный электрон
| 9. валентные  у атома железа: у атома железа:
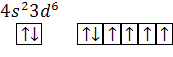 4 неспаренных электрона
4 спаренных электрона
4 неспаренных электрона
4 спаренных электрона
| 9. валентные  у атома теллура: у атома теллура:
 2 неспаренных электрона
4 спаренных электрона
2 неспаренных электрона
4 спаренных электрона
|
| 10. Число возможных атомных орбиталей (АО) на уровне равно N2 уровня, но реально в настоящее время
известны только подуровни: s, p, d, f
|
10. последний уровень:
6-ой: число возможных атомных орбиталей равно: 62 = 36, но реально:
6-ой уровень имеет s, p, d, f-подуровни:
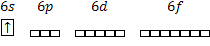 1 занятая АО
15 свободных АО
1 занятая АО
15 свободных АО
| последний уровень:
4-ый: число возможных атомных орбиталей равно: 42 = 16, и реально:
4-ый уровень имеет s, p, d, f-подуровни:
 1 занятая АО
15 свободных АО
1 занятая АО
15 свободных АО
| последний уровень:
5-ый: число возможных атомных орбиталей равно: 52 = 25, но реально:
5-ый уровень имеет s, p, d, f-подуровни:
 4 занятых АО
12 свободных АО
4 занятых АО
12 свободных АО
|
| 11. Возбужденное состояние возможно для тех атомов, у которых на внешнем уровне есть спаренные электроны и
свободные атомные орбитали (АО)
|
 Нет возбужденного состояния, т.к. нет спаренных электронов
Нет возбужденного состояния, т.к. нет спаренных электронов
|  Возможно возбужденное состояние, т.к. на внешнем уровне имеются и спаренные электроны(4s2) и свободные АО(4p):
Fe*
Возможно возбужденное состояние, т.к. на внешнем уровне имеются и спаренные электроны(4s2) и свободные АО(4p):
Fe*
 (на подуровне 4s стрелка должна быть направлена вверх)
(на подуровне 4s стрелка должна быть направлена вверх)
|  Возможно возбужденное состояние, т.к. на внешнем уровне имеются и спаренные электроны(5s2) и свободные АО(5p):
1-ое возбужденное состояние:
Te*
Возможно возбужденное состояние, т.к. на внешнем уровне имеются и спаренные электроны(5s2) и свободные АО(5p):
1-ое возбужденное состояние:
Te*
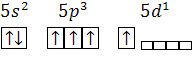 2-ое возбужденное состояние:
Te**
2-ое возбужденное состояние:
Te**

|


 металл
металл
 металл
металл
 неметалл
неметалл
 ).
).
 (катион)
(катион)

 (катион)
(катион)

 (катион)
(катион)

 (анион)
(анион)
 = числу протонов
Число нейтронов (n) = атомная масса – число протонов
= числу протонов
Число нейтронов (n) = атомная масса – число протонов




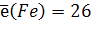










 d-подуровня имеет пять орбиталей: m e = -2, -1, 0, 1, 2
d-подуровня имеет пять орбиталей: m e = -2, -1, 0, 1, 2
 4) ms – спиновое квантовое число может принимать только два значения: если ↑, то ms =
4) ms – спиновое квантовое число может принимать только два значения: если ↑, то ms =  , если ↓, то ms =
, если ↓, то ms = 



 суммарный спин:
суммарный спин:

 суммарный спин:
суммарный спин:

 суммарный спин:
суммарный спин:

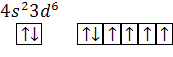 4 неспаренных электрона
4 спаренных электрона
4 неспаренных электрона
4 спаренных электрона
 2 неспаренных электрона
4 спаренных электрона
2 неспаренных электрона
4 спаренных электрона
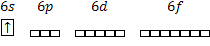 1 занятая АО
15 свободных АО
1 занятая АО
15 свободных АО
 1 занятая АО
15 свободных АО
1 занятая АО
15 свободных АО
 4 занятых АО
12 свободных АО
4 занятых АО
12 свободных АО
 Нет возбужденного состояния, т.к. нет спаренных электронов
Нет возбужденного состояния, т.к. нет спаренных электронов
 Возможно возбужденное состояние, т.к. на внешнем уровне имеются и спаренные электроны(4s2) и свободные АО(4p):
Fe*
Возможно возбужденное состояние, т.к. на внешнем уровне имеются и спаренные электроны(4s2) и свободные АО(4p):
Fe*
 (на подуровне 4s стрелка должна быть направлена вверх)
(на подуровне 4s стрелка должна быть направлена вверх)
 Возможно возбужденное состояние, т.к. на внешнем уровне имеются и спаренные электроны(5s2) и свободные АО(5p):
1-ое возбужденное состояние:
Te*
Возможно возбужденное состояние, т.к. на внешнем уровне имеются и спаренные электроны(5s2) и свободные АО(5p):
1-ое возбужденное состояние:
Te*
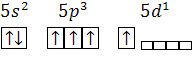 2-ое возбужденное состояние:
Te**
2-ое возбужденное состояние:
Te**




