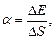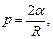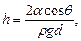Основные формулы. Количество вещества тела (системы)
Количество вещества тела (системы) n = N/NA, где N - число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему); NА - постоянная Авогадро (NА = 6, 02× 1023моль-1). Молярная масса вещества M = m/n, где m - масса однородного тела (системы); n - количество вещества этого тела. Относительная молекулярная масса вещества Mr = SniAr, i, где ni - число атомов i-го химического элемента, входящих в состав молекулы данного вещества; Ar, i - относительная масса этого элемента. Относительные атомные массы приводятся в таблице Д.И.Менделева. Связь молекулярной массы М с относительной молекулярной массой вещества M = Mrk, где k = 10-3 кг/моль. Количество вещества смеси газов n = n1 + n2 + … + nn = N1/NA + N2/NA + … + Nn/NA, или
где ni, Ni, mi, Mi - соответственно количество вещества, число молекул, масса, молекулярная масса i-го компонента смеси. Уравнение Менделеева-Клайперона (уравнение состояния идеального газа)
где m - масса газа, М - молекулярная масса газа, R - молекулярная газовая постоянная, n - количество вещества, Т - термодинамическая температура. Опытные газовые законы, являющиеся частными случаями уравнения Менделеева-Клайперона для изопроцессов: а) закон Бойля-Мариотта (изотермический процесс: T=const, m=const) pV = const, или для двух состояний газа p1V1 = p2V2; б) закон Гей-Люссака (изобарный процесс: p=const, m=const)
или для двух состояний
в) закон Шарля (изохорный процесс: V=const, m=const)
или для двух состояний
г) объединенный газовый закон (m=const)
где p1, V1, T1 - давление, объем и температура газа в начальном состоянии; p2, V2, T2 - те же величины в конечном состоянии. Закон Дальтона, определяющий давление смеси газов, р = р1 + р2 + … + рn где pi - парциальные давления компонентов смеси; n - число компонентов смеси. Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью. Молекулярная масса смеси газов
где mi - масса i-го компонента смеси; ni = mi/Mi - количество вещества i-го компонента смеси; n - число компонентов смеси. Массовая доля i-го компонента смеси газа (в долях единицы или процентах)
где m - масса смеси. Концентрация молекул
где N - число молекул, содержащихся в данной системе; r - плотность вещества; V - объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества. Основное уравнение кинетической теории газов p = где á eпñ - средняя кинетическая энергия поступательного движения молекулы. Средняя кинетическая энергия поступательного движения молекулы á eпñ = где k - постоянная Больцмана. Средняя полная кинетическая энергия молекулы á eiñ = где i - число степеней свободы молекулы. Зависимость давления газа от концентрации молекул и температуры p = nkT. Скорости молекул:
где mi - масса одной молекулы. Относительная скорость молекулы u = u/uB, где u - скорость данной молекулы. Удельные теплоемкости газа при постоянном объеме (сv) и постоянном давлении (cp)
Связь между удельной с и молекулярной С теплоемкостями с = С/М, С = сМ. Уравнение Майера Сp – Cv = R Внутренняя энергия идеального газа
Первое начало термодинамики
где Q - теплота, сообщенная системе (газу); DU - изменение внутренней энергии системы; А - работа, совершенная системой против внешних сил. Работа расширения газа:
A = p(V2-V1) при изобарном процессе;
при адиабатном процессе, где g = сp/cv - показатель адиабаты. Уравнения Пуассона, связывающие параметры идеального газа при адиабатном процессе:
Термический КПД цикла
где Q1 - теплота, полученная рабочим телом от теплоотдатчика; Q2 - теплота, переданная рабочим телом теплоприемнику. Термический КПД цикла Карно
где T1 и T2 - термодинамические температуры теплоотдатчика и теплоприемника. Коэффициент поверхностного натяжения
где F - сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкости; DЕ - изменение свободной энергии поверхностной пленки жидкости, связанное с изменением площади DS поверхности этой пленки. Формула Лапласа, выражающая давление р, создаваемое сферической поверхностью жидкости:
где R - радиус сферической поверхности. Высота подъема жидкости в капиллярной трубке
где q - краевой угол (q = 0 при полном смачивании стенок трубки жидкостью; q = p при полном несмачивании); R - радиус канала трубки; r - плотность жидкости; g - ускорение свободного падения. Высота подъема жидкости между двумя близкими параллельными друг другу плоскостями
где d - расстояние между плоскостями.
|

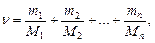

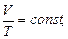
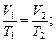
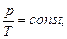

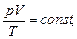 или
или 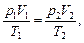

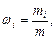
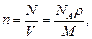
 n á eпñ,
n á eпñ, kT,
kT, kT,
kT,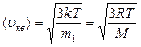 - средняя квадратичная;
- средняя квадратичная;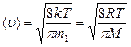 - средняя арифметическая;
- средняя арифметическая;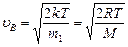 - наиболее вероятная,
- наиболее вероятная,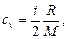



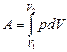 в общем случае;
в общем случае; при изотермическом процессе;
при изотермическом процессе;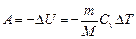 , или
, или 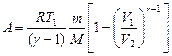

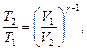
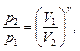


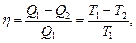
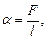 или
или