Модель идеального газа
Число молекул в газе велико: Молекулы газа совершают неупорядоченное, хаотическое движение. Движение отдельных молекул подчиняется законам классической механики. При этом молекулы рассматриваются как материальные точки, совершающие только поступательное движение. Величина потенциальной энергии взаимодействия в среднем мала по сравнению со средней кинетической энергией. Все соударения молекул друг с другом и со стенками сосуда, в котором находится газ, являются абсолютно упругими (происходят без потери энергии). При ударе о стенку компонента импульса молекулы, перпендикулярная стенке, меняет знак. Таким образом, в целом выполняются законы сохранения импульса и энергии для молекул газа. Понятие об усреднении. По определению среднее значение какой - то величины, которая случайным образом в
Ввиду полной хаотичности движения молекул, проекция скорости молекул на ось Аналогично Однако, средние значения квадратов проекций скорости не будут равны нулю. Основное уравнение молекулярно-кинетической теории идеального газа: п роизведение давления идеального газа на его объем пропорционально плотности числа молекул в газе и средней кинетической энергии поступательного движения отдельной молекулы, т.е.:
|

 среднее расстояние между отдельными молекулами много больше их размеров (
среднее расстояние между отдельными молекулами много больше их размеров ( ).
). независимых испытаниях принимает
независимых испытаниях принимает  значений
значений  , равно:
, равно: (54)
(54) , с равной вероятностью, может принимать как положительные, так и отрицательные значения. Поэтому среднее значение проекции скорости
, с равной вероятностью, может принимать как положительные, так и отрицательные значения. Поэтому среднее значение проекции скорости  - ой молекулы на ось
- ой молекулы на ось  равно нулю:
равно нулю:  (55)
(55)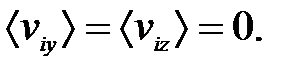 (56)
(56) (57)
(57)


