Основные технологические критерии эффективности
Для оценки качества ХТП используют количественные технологические показатели: степень превращения сырья, селективность образования и выход продукта, производительность реактора или установки, интенсивность работы реактора или катализатора, расходные коэффициенты по реагентам, другим веществам (в ходе ХТП расходуются катализаторы, инерты и т.д.) и энергии. Эти показатели характеризуют степень совершенства ХТП. Рассмотрим основные показатели на примере реакции (1.18), которую будем считать основной реакцией ХТП.
aA+bB= pP (1.18)
1.2.1. Степень превращения (степень конверсии) реагента (Х) – это отношение количества превращенного реагента к введенному в реакционную систему количеству этого реагента. Количества реагента могут быть выражены в единицах массы, молях, в мольных потоках (количество молей вещества, поступающее в реактор или выходящее из реактора в единицу времени) и, даже, в единицах объема, взятых при одинаковых условиях (температуре и давлении).
Если объем реакционной системы остается постоянным в ходе ХТП, то во всех расчетах количества веществ могут быть заменены их молярными концентрациями. При использовании формул (1.19) степень превращения получают в долях единицы. Умножив полученное значение на сто процентов, получим величину Х в процентах. 1.2.2. Выходом продукта по данному реагенту называют отношение количества реагента, превратившегося в данный продукт, к количеству этого реагента, введенного в систему. Эквивалентная формулировка: выход продукта по данному реагенту – это отношение количества продукта, полученного практически, к количеству этого продукта, которое должно быть получено из введенного количества данного реагента в соответствии с уравнением реакции. Обе формулировки выражаются одной формулой. Для уравнения (1.18) выходы продукта Р на реагенты А и В выражаются формулами (1.20).
(1.20),
где
Для уточнения связи формулы (1.20) с двумя формулировками определения выхода перепишем ее для реагента А в двух видах: (1.21) – для первой формулировки, (1.22) – для второй.
Выражение Выход можно рассчитывать для каждого из продуктов по любому из реагентов (а если необходимо, то и по всем реагентам основной реакции). Чаще выход рассчитывают для наиболее ценного (целевого) продукта на наиболее дорогой из реагентов. Например, в синтезе метанола из синтез-газа наряду с основной (1.23) идут побочные реакции (1.24 - 1.26). СО + 2Н2 = СН3ОН 1.23) 2СО + 2Н2 = СН4 + СО2 (1.24) СО + 3Н2 = СН4 + Н2О (1.25) 2СН3ОН = СН3ОСН3 + Н2О (1.26)
Выход метанола (η CH3OH) в соответствии со стехиометрией уравнения (1.23) по оксиду углерода(II) рассчитывают по формуле (1.27), а по водороду – по формуле (1.28).
где
Аналогичным образом может быть рассчитан выход по каждому из побочных продуктов. Очевидно, что практический выход не может превышать равновесный выход при условиях проведения процесса. Для процессов, в которых трудно выделить одну стехиометрическую реакцию образования целевого продукта, и поэтому нельзя рассчитать выход описанным способом, рассчитывают показатель, который также называют выходом или массовым выходом и который представляет собой отношение массы полученного продукта к массе затраченного сырья. Например, выход этилена для процесса пиролиза фракций нефти находят как отношение массы этилена к массе поступившей в реактор фракции нефти. 1.2.3. Селективность – важнейший показатель сложного ХТП, характеризующий эффективность превращения сырья в целевой продукт. Селективность образования продукта по реагенту (φ) – это отношение количества этого реагента, превратившегося в продукт, к общему количеству превратившегося реагента. В отличие от выхода, селективность не учитывает не превратившийся реагент, поэтому этот показатель более чувствителен к соотношению различных направлений химического превращения. Для реакции (1.18) селективность образования продукта Р по реагентам А и В выразится формулами (1.29) и (1.30), в знаменателе которых, в отличие от формул для выхода (1.21) и (1.22), количество превращенного реагента. Символом Nобозначены мольные количества веществ или мольные потоки (для открытых систем, работающих в стационарном режиме).
Для селективности, также как для выхода, есть второе определение: селективность – это отношение количества полученного практически продукта, к количеству этого продукта, которое должно было быть получено из прореагировавшего количества реагента в соответствии со стехиометрией реакции, по которой образуется этот продукт. Если продукт образуется по нескольким реакциям, то селективность, как правило, рассчитать нельзя. Селективность, рассчитанную по формулам (1.29, 1.30) называют интегральной в отличие от дифференциальной селективности. Дифференциальной селективностью (
Например, для реакции синтеза метанола (1.23) интегральную селективность образования метанола по СО и по Н2 рассчитывают по формулам (1.32) и (1.33), соответственно.
1.2.4. Взаимосвязь степени превращения реагента, выхода и интегральной селективности образования продукта по этому реагенту легко получить, перемножив выражения для степени превращения (1.19) и селективности (1.29). Сократив одинаковые члены в числителе и знаменателе, получим (1.34) (сравнить с (1.21)).
Очевидно, что для простых ХТП селективность равна единице (100%) для всех продуктов единственной реакции (стехиометрического уравнения). В этом случае выход каждого из продуктов реакции по любому из реагентов равен степени превращения этого реагента ( В случае сложных ХТП для получения высокого выхода необходимо иметь высокие значения и степени превращения, и селективности. Если процесс протекает с полным превращением реагента, то выход продуктов по этому реагенту равен селективности образования каждого из продуктов по данному реагенту. Например, в контактном окислении аммиака весь поступающий в процесс аммиак реагирует, превращаясь в оксид азота и побочные продукты. Выход оксида азота в этом случае равен селективности образования NO по аммиаку.
1.2.5. Производительность аппарата. Производительность аппарата (П) - это масса (или объем) выработанного целевого продукта за единицу времени:
где G – масса (или объем) продукта, полученная за время t 1.2.6. Интенсивность работы аппарата. Интенсивностью работы аппарата (I) называют его производительность, отнесенную к какой-либо величине, характеризующей размеры данного аппарата. Обычно производительность относят к объему аппарата V или к площади его сечения S:
В каталитических процессах рассчитывают интенсивность работы катализатора, для чего массу полученного за единицу времени целевого продукта относят к объему катализатора Vk:
1.2.7. Материальный баланс ХТП. Материальный баланс ХТП является следствием закона сохранения массы вещества. Это означает, что масса веществ, поступивших на технологическую операцию - приход, равна массе полученных веществ - расходу. Материальный баланс должен соблюдаться для ХТП всех типов, синтеза, разделения, очистки целевых продуктов. Данные о материальном балансе позволяют дать оценку целесообразности осуществления процесса в заданных условиях. Эти данные нужны как при проектировании новых, так и при анализе работы существующих производств. По данным материального баланса рассчитывают технологические показатели процесса: выход целевого продукта, степень превращения сырья, селективность процесса, расходные коэффициенты по сырью и т.д. Материальный баланс является необходимым элементом при расчете энергетического и эксергетического балансов.
Материальный баланс сводят, пользуясь уравнениями основной и побочных реакций. Когда учитывают не все происходящие побочные реакции и полученные побочные продукты, а лишь наиболее важные из них, материальный баланс имеет приблизительный характер. Существуют три основные формы составления материального баланса. В виде системы уравнений, таблицы и поточной диаграммы. Уравнение материального баланса в общем виде: GAO+ GBO+... = GR +...+ GD +...+ GA + GB + DG,
где GAO, GBO - массы исходных реагентов (сырья). GR - масса целевого продукта, GD - масса побочного продукта, GА, GВ - массы не прореагировавших веществ, DG - невязка баланса.
Невязка баланса является следствием потерь сырья и продуктов при проведении процесса, неточности эксперимента и расчета, а также принятых допущений. Чаще всего материальный баланс процесса представляют в виде таблицы:
В таблицу материального баланса, кроме обязательных масс и массовых процентов введенных и получающихся веществ, включают еще и объемы веществ, находящихся в газовой фазе, приведенные к нормальным условиям. Массовые проценты в столбце “Расход” рассчитывают по отношению к сумме масс введенных реагентов в столбце “Приход”, т.е. массу всех введенных реагентов принимают за 100%. Может случиться, что из-за погрешностей эксперимента и допущений, принятых при расчете, масса полученных веществ окажется больше массы введенных. Тогда невязка баланса будет иметь отрицательное значение. Материальный баланс составляют на заданный базис. Обычно базисом является масса сырья или целевого продукта (кг, т) или продолжительность процесса (ч, сутки). В лабораторных исследованиях составляют баланс за время проведения опыта. В дальнейшем производят пересчет на заданный базис, пользуясь коэффициентом пересчета. Коэффициент пересчета показывает, во сколько раз нужно изменить массы веществ, входящих в материальный баланс, при переходе на другой базис. Так, если в материальном балансе, составленном за время проведения опыта, получили GR грамм целевого продукта, а заданный базис расчета - 1000 г целевого продукта, коэффициент пересчета равен 1000 / GR. В названии таблицы материального баланса указывают, для какого процесса и реактора произведен расчет, а также принятый базис расчета. Поточная диаграмма это блок-схема (рис.1.3). Материальные потоки изображают в виде полос, ширина которых пропорциональна массе в выбранном масштабе. Основным преимуществом данного способа изображения является его наглядность.
Рис.1.3. Поточная диаграмма колонны синтеза аммиака: 1 - свежий газ; 2 - циркулирующий газ; 3 - жидкий аммиак и растворенные в нем газы; 4 - отдувочные газы
1.2.8. Расходные коэффициенты по сырью. К основным показателям ХТП относятся расходные коэффициенты, характеризующие затраты сырья, воды, топлива, электроэнергии, пара на единицу массы целевого продукта. В связи с большим вкладом затрат на реагенты (сырье) в себестоимость продуктов в химической технологии особое значение имеют расходные коэффициенты по реагентам. Различают теоретические и практические расходные коэффициенты. Теоретический расходный коэффициент g стех рассчитывают, пользуясь стехиометрическим уравнением, описывающим химическое превращение (1.18):
где MA и MP - молекулярные массы реагента и продукта а и р - стехиометрические коэффициенты.
Теоретический расходный коэффициент характеризует минимальный расход сырья на единицу массы продукта. Практический расходный коэффициент g отражает реальный расход поступившего в процесс сырья на единицу массы продукта, т.е. его рассчитывают как отношение массы поступившего в процесс сырья
Расходные коэффициенты рассчитывают по всем реагентам. Практические расходные коэффициенты всегда больше стехиометрических из-за неполноты превращения сырья, а также из-за расходования сырья на побочные реакции. Данные для расчета практических расходных коэффициентов берут из материального баланса процесса. Практический расходный коэффициент по реагенту можно найти, зная теоретический расходный коэффициент и выход целевого продукта по этому реагенту:
где
|

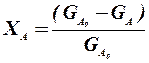 ;
;  (1.19), где
(1.19), где 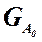 и
и  - массы введенного и непрореагировавшего реагента А, соответственно;
- массы введенного и непрореагировавшего реагента А, соответственно;  и
и 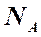 – те же величины, выраженные в молях.
– те же величины, выраженные в молях.

 ,
,  и
и  количества молей продукта Р, полученное в реакции (1.18), и реагентов А и В, введенные в реакционную систему, соответственно, а, b и p – стехиометрические коэффициенты реакции (1.18).
количества молей продукта Р, полученное в реакции (1.18), и реагентов А и В, введенные в реакционную систему, соответственно, а, b и p – стехиометрические коэффициенты реакции (1.18). (1.21);
(1.21); (1.22)
(1.22) в формуле (1.21) – это количество молей реагента А, из которого образуется NP молей продукта Р в соответствии с уравнением (1.18) и т.д.
в формуле (1.21) – это количество молей реагента А, из которого образуется NP молей продукта Р в соответствии с уравнением (1.18) и т.д. (1.27);
(1.27); (1.28),
(1.28),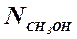 – полученное количество молей метанола,
– полученное количество молей метанола,  и
и 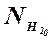 – введенные в систему количества молей СО и Н2.
– введенные в систему количества молей СО и Н2.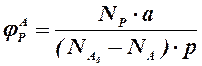 (1.29)
(1.29)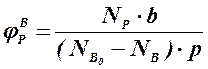 (1.30)
(1.30)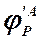 ) образования продукта Р по реагенту А называют отношение скорости расходования реагента А на образование продукта Р к суммарной скорости превращения А. Рассчитывают дифференциальную селективность как отношение скоростей образования продукта и расходования реагента, умноженное на обратное отношение стехиометрических коэффициентов. (1.31 для реакции 1.18). Член
) образования продукта Р по реагенту А называют отношение скорости расходования реагента А на образование продукта Р к суммарной скорости превращения А. Рассчитывают дифференциальную селективность как отношение скоростей образования продукта и расходования реагента, умноженное на обратное отношение стехиометрических коэффициентов. (1.31 для реакции 1.18). Член  в уравнении (1.31) равен скорости расходования А на образование Р.
в уравнении (1.31) равен скорости расходования А на образование Р.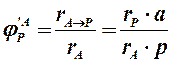 (1.31)
(1.31) (1.32);
(1.32); (1.33)
(1.33) (1.34)
(1.34)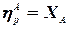 ).
). (кг/ч, т/ч, м3/ч)
(кг/ч, т/ч, м3/ч) (кг/м3× ч),
(кг/м3× ч),  (кг/м2× ч)
(кг/м2× ч) (кг/мk3× ч)
(кг/мk3× ч)




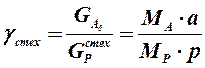

 и
и  - массы реагента и продукта из уравнения реакции
- массы реагента и продукта из уравнения реакции к массе получившегося продукта GР:
к массе получившегося продукта GР:

 - выход Р по реагенту А в долях единицы.
- выход Р по реагенту А в долях единицы.


