Одержання. §13.4. Карбоксильні сполуки
§13.3.3. Хімічні властивості Застосування §13.4. Карбоксильні сполуки §13.4.1. Карбонові кислоти Естери. §13.4.3. Ліпіди.
Розділ 14. ВУГЛЕВОДИ §14.1. Вуглеводи. Їх класифікація. §14.2. Моносахариди. Будова. Ізомерія. §14.3. Дисахариди. Їх будова та властивості §14.4. Полісахариди
Розділ 15. НІТРОГЕНВМІСНІ ОРГАНІЧНІ СПОЛУКИ §15.1. Нітросполуки. §15.2. Аміни §15.3. Амінокислоти. §15.4. Пептиди. Білки
Додатки
1. Періодична частина хімічних елементів Д.І. Менделеєва. 2. Класифікація оксидів 3. Таблиця розчинності солей, кислот і основ у воді.
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ План §1.1. Класифікація речовин. §1.2. Хімічні елементи. §1.3. Атомно-молекулярне вчення. Поняття «атом» і «молекула». §1.4. Відносна атомна та молекулярна маса. §1.5. Моль. Молярна маса. Закон Авогадро. §1.6. Основні закони хімії. §1.7. Приклади розв’язування задач на основні законів хімії.
ХІМІЯ - це наука, яка вивчає речовини, їх будову, властивості і перетворення в результаті хімічних реакцій. Хімія вивчає будову речовин у взаємозв'язку з їх властивостями. Хімія вивчає також явища, які супроводжують перетворення речовин (хімічні реакції). Для лікаря хімія – це головна теоретична наука. В кожній клітині організму людини може одночасно відбуватись більше 2000 хімічних реакцій. Порушення цих процесів веде до паталогічних змін. Ліки, як хімічні речовини втручаються в метаболічні перетворення в організмі і людина видужує.
§1.1. Класифікація речовин Все що ми бачимо в природі – це тіла. Рослини, тварини, люди і всі предмети – це тіла. Всі фізичні тіла складаються з РЕЧОВИН. Сіль, глюкоза, кисень, вода – це речовини. Атоми елементів з'єднуються між собою і утворюють речовину. РЕЧОВИНА - це вид матерії. Речовини поділяються на прості та складні.
Складні речовини діляться на органічні та неорганічні. На даний час відомо приблизно 500 видів простих речовин, 700 тисяч складних неорганічних і 18 мільйонів органічних речовин. · ОРГАНІЧНІ РЕЧОВИНИ містять один або декілька атомів карбону. Наприклад: СН4 – метан, С6Н12О6 – глюкоза, СН3СООН – ацетатна кислота, білки, ліпіди, вуглеводи – це органічні речовини. · НЕОРГАНІЧНІ РЕЧОВИНИ не містять атомів карбону. Винятком є такі речовини: С, СО2, Н2СО3, МеСО3 (МеСО3 – це карбонат будь-якого металу). Це – неорганічні сполуки карбону. Приклад неорганічних речовин: НСl – хлороводень, Са(ОН)2 – кальцію гідроксид, NH4NO3 - амонію нітрат. Na2SO4 – натрію сульфат. · ЧИСТА речовина – церечовина, яка складається з частинок одного виду (атомів, молекул, йонів) і має постійні фізичні властивості. Наприклад: мідь, сірка, кисень, залізо. · СУМІШІ складаються з двох або більше чистих речовин, які зберігають свої фізичні та хімічні властивості. Наприклад: повітря, газована вода, молоко, полівітаміни, кров.
Чиста речовина Чиста речовина Суміш СПОСОБИ РОЗДІЛЕННЯ СУМІШЕЙ
РЕЧОВИНА - це вид матерії, який має певні ХІМІЧНІ І ФІЗИЧНІ властивості. Властивості речовин – це ознаки, за якими речовини відрізняються одна від одної або подібні між собою.
ХІМІЧНІ ВЛАСТИВОСТІ – це здатність речовин змінюватися і реагувати з іншими речовинами. Наприклад: С + О2 = СО2 – вуглець РЕАГУЄ з киснем, і утворюється вуглекислий газ.
§1.2. Хімічні елементи Кожний окремий вид атомів має назву хімічного елемента. ХІМІЧНИЙ ЕЛЕМЕНТ – це сукупність атомів, що мають однаковий заряд ядра. До початку ХХІ століття відомо близько 120 хімічних елементів. Кожний хімічний елемент має свою назву і символ. Одна або дві букви латинської назви хімічного елементу - це хімічний знак або ХІМІЧНИЙ СИМВОЛ. Як читати хімічні символи? Якщо символ складається з однієї букви – читається буква (Р - пэ, С - це, Н - аш), якщо з двох букв – читається повна назва елементу (Nа – натрій, Са – кальцій, Cl – хлор, Si – сіліціум, Fe – ферум, Hg – гідраргіум). Символ позначає: • назву елементу; • один атом (моль атомів) елемента; • відносну атомну масу елемента (Аr); • молярну масу елементу (М); • атомний (протонний) номер елементу Z (рівний сумі протонів в ядрі) Наприклад: – сульфур S, один атом сульфуру, або моль атомів сульфуру – 6, 02•1023 атомів, Аr (S) = 32 а.о.м, Z = 16.
Таблица 1. Назви і символи деяких елементів.
§1.3. Атомно-молекулярне вчення. Поняття «атом» і «молекула» Основні положення атомно-молекулярного вчення сформулював російський вчений Михайло Васильович Ломоносов в 1749 році і англійський учений Джон Дальтон в 1804 році. Сучасне атомно-молекулярне вчення формулюється так: 1. Всі речовини складаються з МОЛЕКУЛ. Проте, є речовини молекулярної (наприклад О2, H2O) і немолекулярної (наприклад Fe, Al, He) будови. 2. Молекули складаються з АТОМІВ. 3. Атоми і молекули постійно рухаються. 4. Між молекулами є ІНТЕРВАЛИ. В газах вони більші, ніж в рідких і твердих речовинах. 5. Між молекулами діють СИЛИ ПРИТЯГАННЯ.
· АТОМ – це найменша електронейтральна частинка хімічного елементу, що не змінюється в хімічних реакціях. Атом складається з ядра і електронів, що обертаються навколо ядра. Ядро має позитивний (+) заряд, а електрони – негативний (–). Атом визначає властивості хімічного елементу. Приклад: Fe - атом заліза, С - атом карбону. · МОЛЕКУЛА – це найменша частинка речовини, яка зберігає її хімічні властивості. Хімічні властивості молекул визначаються їх складом та хімічною будовою. Приклад молекул: Н2О – молекула води, О2 – молекула кисню.
§1.4. Відносна атомна та молекулярна маса ВІДНОСНА АТОМНА МАСА ХІМІЧНОГО ЕЛЕМЕНТУ (Аr) – показує, в скільки разів маса атома більша 1/12 атома Карбону С12. Відносна маса елементу вказана в періодичній таблиці. Маси атомів і молекул в грамах дуже малі. Тому для вимірювання цих використовують не грам, а міжнародну величину (а.о.м) (а томну о диницю м аси). а.о.м. - це стандартна одиниця маси атомів і молекул в хімії. Наприклад, Аr(К) = 39 а.о.м. (атомних одиниць маси), Аr(Р)= 31 а.о.м.
ВІДНОСНА МОЛЕКУЛЯРНА МАСА (Mr) – це число, яке показує, в скільки разів молекула важче 1/12 маси атома Карбону С12. Відносна молекулярна маса дорівнює сумі атомних мас атомів, що входять до складу речовини. Наприклад: Mr(СO) = Ar(С)+ Ar(O) = 12 + 16 = 28. Mr(Fe2O3)= 2•Ar(Fe) + 3•Ar(O) = 2•56 + 3•16 = 160.
ХІМІЧНА ФОРМУЛА показує, з яких елементів складається сполука і скільки атомів кожного елементу входить до складу її молекули. Зображають склад речовини за допомогою хімічних символів і цифр – індексів. Наприклад: Аl2(SО4)3 – формула алюмінію сульфату, де 2, 4, 3 – індекси. Індекс позначає число атомів кожного елементу в молекулі (2, 4) або число складних йонів в молекулі (3). Формула позначає: • назву і клас речовини; • одну молекулу (моль молекул)речовини; • відносну молекулярну і молярну маси речовини; • якісний склад речовини (з атомів яких елементів складається речовина); • кількісний склад речовини (скільки атомів кожного елементу є в молекулі речовини); Наприклад: НNО3 - одна молекула нітратної кислоти або моль (6, 02•1023 молекул) азотної кислоти, Mr(НNО3) = 63, М (НNО3) = 63 г/моль. Нітратна кислота складається з атомів Гідрогену, Нітрогену та Оксигену в кількісному співвідношенні 1: 1: 3. Види хімічних формул 1. Емпіричні формуливідображають кількісний і якісний склад молекул: N2, NH3, H2O. 2. Електронні формули відображають порядок сполучення атомів у молекулі, а також природу і механізм утворення хімічних зв’язків. Крапками позначають електрони зовнішнього рівня, що йдуть на утворення хімічного зв’язку:
3. Структурні формули – це формули, в яких кожна електронна пара, що утворює зв′ язок, зображується рискою:
ХІМІЧНА РЕАКЦІЯ – це процес перетворення вихідних речовин (реагентів) в кінцеві речовини (продукти). Цей процес супроводжується зміною складу і будови молекул речовин. Хімічні реакції записують за допомогою хімічних рівнянь і схем. Схема показує початкові речовини і продукти реакції без врахування їх кількості. Наприклад: Р + О2 ® Р2О5 ХІМІЧНЕ РІВНЯННЯ – це умовне зображення хімічної реакції за допомогою хімічних формул і коефіцієнтів. Сума атомів кожного елементу до реакції повинна дорівнювати сумі атомів кожного елементу після реакції. Наприклад: 4Р + 5О2 = 2Р2О5
вихідні речовини кінцеві речовини (РЕАГЕНТИ) (ПРОДУКТИ реакції) Що показують цифри в рівнянні реакції? Наприклад: 5О2: де 5 – коефіцієнт, показує, скільки молекул вступає в реакцію, 2 –індекс, показує, скільки атомів з'єднується в молекулу. Знак «=» ставиться на основі ЗАКОНУ ЗБЕРЕЖЕННЯ МАСИ речовин, який відкрив Михайло Васильович Ломоносов в 1748 році Як читається хімічне рівняння? Наприклад: 4 А1 + 3О2 = 2 А12О3 Читаємо:
|







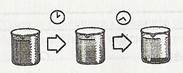 1).Відстоювання (тверді нерозчинні частинки осідають на дно стакана)
1).Відстоювання (тверді нерозчинні частинки осідають на дно стакана)
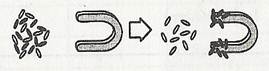 2). Дія магнітом (частинки заліза притягуються магнітом).
2). Дія магнітом (частинки заліза притягуються магнітом).
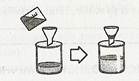 3). Фільтрування(тверді нерозчинні частинки затримуються паперовим фільтром)
3). Фільтрування(тверді нерозчинні частинки затримуються паперовим фільтром)
 4). Випарювання(розчинник випаровується, розчинна речовина залишається в розчині, і при охолодженні випадає в осад)
4). Випарювання(розчинник випаровується, розчинна речовина залишається в розчині, і при охолодженні випадає в осад)
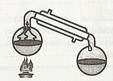 5). Перегонка(рідина випаровується і конденсується в іншій колбі)
5). Перегонка(рідина випаровується і конденсується в іншій колбі)

 (H2),
(H2),  (HCl),
(HCl),  (BF3)
(BF3)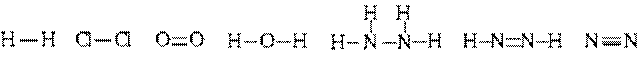

 3NaOH + H3PO4 = Na3PO4 + 3H2O
3NaOH + H3PO4 = Na3PO4 + 3H2O


