Микрофагоциты: искусственные иммунные клетки
Ревматоидным артритом болеют около 1– 2,5% населения Европы и Америки, и приблизительно у 60-80% таких больных обнаруживаются различные виды микоплазм или их антигены. Это обстоятельство, а также воспроизведение заболевания, сходного с ревматоидным артритом, при экспериментальном заражении животных дают основание рассматривать микоплазмы как возможных возбудителей ревматоидного артрита. Однако многие вопросы, касающиеся этиологии, способа заражения и механизма патогенеза ревматоидного артрита, требуют изучения. Из синовиальной жидкости и ткани суставов при ревматоидном артрите выделяют М. arthritidis, М. fermentans, M. pneumoniae и U. urealyticum, дифференциальные признаки их указаны в табл. 47. Отличительной особенностью М. arthritidis является также то, что они способны разжижать желатин, но не свертывают сыворотку, не гидролизуют казеин. Данных о способности их колоний адсорбировать эритроциты опубликовано не было. Гемолизин идентифицирован как Н2О2. Источником возбудителя ревматоидного артрита является больной человек или бессимптомный носитель микоплазм. Лабораторная диагностика основана на выделении возбудителя из синовиальной жидкости, ткани суставных хрящей и последующей его идентификации или на обнаружении возбудителя (его антигенов) в исследуемых биосубстратах ив сыворотке крови (в том числе в составе циркулирующих иммунных комплексов) с помощью иммунофлуоресценции, РСК, РПГА, РАГА и ИФМ. Для диагностики заболеваний, вызываемых микоплазмами и хламидиями, все шире используется метод ЦПР. В России создана и применяется тест-система «Полимик», содержащая реагенты, в том числе праймеры, для обнаружения ДНК Chlamydia trachomatis, Mycoplasma hominis и Ureaplasma urealyticum в биологических пробах. Иммунитет. Развитие иммунного ответа не сопровождается формированием специфической резистентности; для респираторного и урогенитального микоплазмоза характерны случаи повторного заражения. Фагоцитоз незавершенный, при отсутствии AT макрофаги не способны фагоцитировать микоплазмы, что обусловлено наличием микрокапсул, поверхностных АГ, перекрестно реагирующих с АГ некоторых тканей организма человека (легкие, печень, головной мозг, поджелудочная железа, гладкая мускулатура и эритроциты). В цитоплазме нейтрофилов возбудитель сохраняет свою жизнеспособность. Микоплазмы чувствительны к компонентам комплемента, их дефицит или дефекты создают условия для персистенции возбудителя. Короткоживущие IgA определяют элиминацию возбудителя со слизистых оболочек; поликлональная стимуляция лимфоцитов ведет к формированию инфильтратов в легочной ткани, появлению перекрестно реагирующих AT и развитию ГЗТ. Для микоплазмоза характерно развитие аутоиммунных реакций. Инфекция М. fermentans сопровождается образованием AT к IgG (за счет связывания Fc-фраг-ментов), т. е. ревматоидного фактора, участвующего в повреждении клеток. Повреждение суставных тканей индуцируют AT, перекрестно реагирующие с АГ тканей организма при повреждении целостности хрящевой ткани и обнажении «скрытых» клеточных АГ. Микробиологическая диагностика. При подозрении на респираторный микоплазмоз исследуют мазки из носоглотки, лаважную жидкость, мокроту, бронхиальные смывы, а также мазки-отпечатки тканей органов мертворожденных и абортированных плодов. При урогенитальных инфекциях исследуют срединную порцию утренней мочи, соскобы со слизистой уретры, сводов влагалища, цервикального канала, материал, полученный при лапароскопии, амниоцентезе, мазки-отпечатки тканей органов мертворожденных и абортированных плодов. При простатите исследуют секрет простаты, при мужском бесплодии – сперму. При заборе материала соблюдают те же правила, как и при исследовании на хламидиоз. Для лабораторной диагностики микоплазменных инфекций используют культуральный, серологический и молекулярно-генетический методы. При серодиагностике материалом для исследования служат мазки-отпечатки тканей, соскобы из уретры, цервикального канала и влагалища, секрет простаты и сперма, в которых можно обнаружить АГ микоплазм в прямой и непрямой РИФ. Микоплазмы и уреаплазмы окрашиваются в ярко-зеленый цвет и выявляются на поверхности анализируемых клеток в виде зеленых гранул, расположенных группами или по одиночке, окрашенные зеленые гранулы могут располагаться в неклеточном пространстве. Цитоплазма клеток окрашивается в красно-бурый цвет. Результат считается положительным, если в препарате обнаруживают не менее 10 светящихся зеленых гранул, расположенных на мембране клеток. АГ микоплазм могут быть обнаружены также в сыворотке крови больных. Для этого используют реакцию агрегат-гемагглютинации (РАГА) и ИФА. Особенность РАГА заключается в том, что для сенсибилизации эритроцитов используют агрегированные глютаровым альдегидом белки иммунной сыворотки, при этом AT вводятся в состав трехмерных белковых комплексов, вследствие чего часть активных центров AT отдаляется от поверхности эритроцита и становится более доступной для детерминант АГ. Для серодиагностики респираторного микоплазмоза определяют специфические AT в парных сыворотках больного, диагностическое значение имеет сероконверсия в 4 раза и более. Определение AT при урогенитальных инфекциях имеет меньшее диагностическое значение, так как инфекция, как правило, имеет хроническое течение, а «урогенитальные микоплазмы» являются слабыми антигенными раздражителями. Тем не менее и при урогенитальных микоплазмозах в ряде случаев проводят серодиагностику, AT определяют чаще всего в РПГА и ИФА. Молекулярно-биологические методы диагностики включают гибридизацию на основе ДНК-зондов и ПЦР. Первый метод позволяет идентифицировать виды микоплазм при наличии 10 000-100 000 клеток на пробу. ПЦР позволяет выявить единичные клетки микоплазм. Лечение. Антибиотиками. Направленная этиотропная химиотерапия обычно дает хороший эффект, однако исчезновение клинической симптоматики часто не означает полную элиминацию возбудителя. Профилактика. Специфическая профилактика отсутствует. Не специфическая профилактика направлена на ликвидацию источника инфекции; на разрыв механизма и путей передачи; а также на повышение невосприимчивости коллектива к инфекции.
Микрофагоциты: искусственные иммунные клетки Опубликовано Tiniel в 3 апрель, 2007 - 14:17.
Люди часто спрашивают о примерах тех уникальных возможностей, которые нанороботы могут принести медицине. Правда ли, что некоторые простые вещи, исполняемые нанороботами, не могут быть реализованы с помощью биотехнологий? Респироциты — искусственные красные клетки крови — один из ответов на этот вопрос. Их функциональность во много раз превосходит существующие эритроциты: это и возможность переносить больше кислорода, чем природный аналог, и высокая долговечность, и возможность перепрограммирования (что вообще в данное время не может реализовать биотехнология), и высокое быстродействие. В живых системах быстродействие играет основную роль. Наномедицина предлагает мощные инструменты для борьбы с человеческими заболеваниями и для потенциального улучшения человеческого организма. Выполненные из алмазоида медицинские нанороботы могут внести улучшения возможностей нашего организма выше природных. Клоттоциты, например, заменяя «родные» человеческие тромбоциты достигают прекращения кровотечения (искусственный быстродействующий гемостазис) за 1 секунду, причем кровотечение может быть довольно обширным (физическое повреждение тканей) или небольшим внутренним. При этом концентрация искусственных тромбоцитов меньше натуральных в 100 раз. То есть, клоттоциты в 10000 раз эффективней природного аналога, т.к. время нормального тромбогенеза колеблется от 5 до 17 минут. Рассмотрим далее еще одну составляющую «механизированной крови» — механических фагоцитов или микрофагоцитов. На самом деле, микрофагоцитами можно назвать целый класс нанофагоцитов. Различные представители этого класса выполняли бы различные функции в организме — от линии первого реагирования в крови (внутривенные) до внутритканевых и внутрицереброспинных. Но общая цель подобных устройств — уничтожение микробиологических патогенов, найденных в организме человека, используя метод «перевари-и-выброси», детально описанный автором в [1]. Полная версия инженерного описания микрофагоцитов может быть прочитана в [4], ресурс на английском языке. Сепсис, известный также как заражение крови — это наличие в крови патогенных микроорганизмов. Если размножение микроорганизмов не контролировать, то инфекция будет прогрессировать. Бактеремия — наличие бактерий в кровеносной системе человека. Хоть в крови и много веществ, которыми могут питаться бактерии, однако кровь обычно не содержит микроорганизмов (бактерий). Основная противомикробная защита кровеносной системы — циркулирующие нейтрофилы и моноциты (белые кровяные тельца), способные к фагоцитозу (захвату и перевариванию других клеток) и продукции иммуноглобулина, формируя иммунный ответ. Однако, несмотря на это, в кровеносной системе человека может присутствовать небольшое количество бактерий. Чистка зубов, например, вызывает небольшое их движение в гнездах, что приводит к попаданию микроорганизмов, находящихся в ротовой полости, в кровеносную систему [5]. Бактерии также могут попадать в кровь через раны на коже, деснах, языке [6]. Бактерии также попадают в кровь в течении хирургических операций, лечения зубов, а также после инъекций, цитоскопии, анализа крови и даже при замене клапана сердца на искусственный [6]. Эти бактерии обычно уничтожаются лейкоцитами (а также ретикулоэндотелиальными фагоцитами печени, легких и лимфатической системы). Однако некоторое количество вирулентных (вредных для человека, смертоносных) бактерий все же могут обойти естественную защиту. Центр Здравоохранения утверждает, что около ~25,000 граждан США ежегодно умирают от бактериального сепсиса. В настоящее время используют ряд антибиотиков для подавления сепсиса, принимая их в количестве нескольких миллиграмм в день. Такой метод лечения длится иногда недели или даже месяцы для того, чтобы уничтожить патогенные бактерии, такие, как, например, Pseudomonas aeruginosa или Salmonella. Комплекс наноустройств, способный быстро очищать кровь человека от патогенов при сравнительно небольшой концентрации нанороботов, был бы желательным дополнением в современном терапевтическом арсенале. Такой робот назовем микрофагоцитом, или искусственным механическим белым кровяным телом. Микрофагоцит — это сфероидальное наномедицинское устройство, состоящее из 610 биллионов точно расположенных атомов, плюс около 150 биллионов молекул газа или воды, когда резервуары устройства будут заполнены. Размеры наноробота — 3.4 мкм в диаметре вдоль главной оси, и 2.0 мкм вдоль оси, перпендикулярной к главной. Такие размеры дают наноустройству возможность беспрепятственно проникать в мельчайшие капилляры, диаметр которых ~4 мкм [1]. Его сравнительно большой для наноустройства объем (12.1056 мкм3) дает возможнть разместить внутри наноробота два пустых внутренних резервуара объемом 4 мкм3. Наноустройство потребляет 100—200 пВт (пикоВатт) мощности при работе и может полностью «переварить» микробов, находящихся во внутреннем резервуаре наноустройства со скоростью 2 мкм3 за 30-секундный цикл. Как и в предыдущих проектах нанороботов (прим. перев. — проектах Роберта Фрайтаса) [2], для того, чтобы гарантировать надежную работу наноустройства, микрофагоцит спроектирован с десятикратным запасом по всем основным характеристикам, исключая большие пассивные структурные элементы (такие, например, как корпус). Масса «пустого» устройства — 12.2 пикограмм (см. рис. 1).
Опишем работу наноустройства. В течение каждого цикла операций, выполняемых устройством, патогенная бактерия прилипает к поверхности наноробота, как муха на липкую ленту, благодаря специальным обратимым «присоединительным гнездам» [1]. Затем телескопические наноманипуляторы, изготовленные по примеру «руки робота», выдвигаются из специальных гнезд на поверхности микрофагоцита и, достигнув жесткого прикрепления к мембране бактерии, транспортируют микроорганизм к входному порту на передней части устройства, где бактерия оказывается в умертвительном резервуаре объемом 2 мкм3 (см. рис. 2). После интенсивного механического перемалывания бактерии (или бактерий) органические остатки выдавливаются специальным поршнем в «дигестальный» резервуар объемом 2 мкм3, где остатки перевариваются с помощью запрограммированной последовательности 40 специально сконструированных энзимов, которые сменяются около шести раз. В результате полученные остатки будут представлять собой простые аминокислоты, мононуклеотиды, глицерин, воду, жирные кислоты и простые сахара, абсолютно безвредные для организма человека. Далее они выбрасываются в кровеносную систему пациента. Все эти операции происходят в течение 30-секундного цикла.
Этот протокол, названный автором «перевари-и-выброси», [1] практически идентичен процессам переваривания и фагоцитоза, которые используют натуральные фагоциты. Однако искусственный процесс фагоцитоза будет намного быстрее и чище — продукты механических микрофагоцитов не будут содержать вредных для человека веществ. Например, всем известные макрофаги после фагоцитоза патогенных микроорганизмов выбрасывают в кровь биологически активные вещества [7], в то время как продукты фагоцитоза микрофагоцитов будут биологически неактивными и не представляющими угрозу для человека. Обычные фагоциты больше по объему в 100—1000 раз, чем искусственные, при этом они потребляют на фагоцитоз столько же энергии. Например, изменение теплоэнергии от обычных человеческих нейтрофилов при фагоцитозе составляет 19 пикоВатт. Это число растет с увеличением частиц, которые захвачены фагоцитом [8]. Т-лимфоцит объемом около 400 мкм3 при иммунном ответе потребляет ~45 пикоВатт [9]. Захват микроорганизмов натуральными фагоцитами длится недолго — порядка нескольких минут; зато полный цикл переваривания и экскреции может длиться часами. В то время как макрофаги могут захватить и переварить около ~25% их объема в час [10], механические микрофагоциты могут обработать ~2000% своего объема в час. Это значит, что механические фагоциты эффективнее обычных в ~80 раз. Другими словами, аналогичный объем нанороботов может переварить патогенные бактерии в 80 раз быстрее натуральных фагоцитов. Жизненный цикл многих естественных фагоцитов (например, нейтрофилов), колеблется от нескольких часов в крови или нескольких дней в тканях. В одном эксперименте [11] 1—100 патогенов S. aureus или S. faecalis bacteria были помещены к отдельному нейтрофилу, который уничтожил большую их часть при такой высокой концентрации. При повышении концентрации патогенов (100:1) нейтрофилы могли уничтожить около 9 S. aureus bacteria за цикл фагоцитоза, в то время как нейтрофилы при хроническом заболевании грануломатозе могут уничтожить около 14 S. faecalis bacteria за цикл фагоцитоза. Для сравнения, один механический микрофагоцит может уничтожить до ~3000 микроорганизмов P. aeruginosa bacteria в день, при этом жизненный цикл механических устройств практически не ограничен.
В более детальном описании микрофагоцитов [4] представлена простая математическая модель фармакокинетических свойств определенной дозы устройств, инъектированных в человеческую кровеносную систему. Результаты математической модели были следующими: при терапевтической дозе наноустройств в 1-теработ (1012 устройств) можно устранить легкую бактеремию (0.1×106 патогенных единиц (ПЕ) на 1 мл) от 5.4×108 ПЕ в кровеносной системе человека, до <1 ПЕ за 460—5400 секунд (8—90 мин), если при этом необходимо 1—10 столкновений бактерии с микрофагоцитом для достижения «прилипания» патогена к поверхности наноробота. Средняя бактеремия (100×106 ПЕ/мл) будет устранена за 620—7300 сек (10—120 мин). При этом необходимо заметить, что 1-теработ внутривенная доза (~ 12 см3 инъекция) микрофагоцитов, составит концентрацию наноустройств в крови взрослого человека (нанокрит) Nнанокрит ~ 0.2%, выделяя тепловой энергии около 100—200 Вт, что составляет максимальную терапевтическую дозу по теплогенному действию на организм для медицинских наноустройств [1]. В то время как микрофагоциты могут полностью устранить сепсис за минуты или часы, естественные защиты организма (даже подкрепленные антибиотиками) могут достичь того же результата за недели или даже месяцы. Поэтому иммунитет, построенный на микрофагоцитах, будет в ~1000 более быстродействующим, чем естественные защиты. Еще одно полезное сравнение: многие антибактериальные агенты (например, против E. coli) могут повысить LD50 этого патогена ~500-раз, используя антибиотики [12] или ~850-раз, используя антитела [13]. Например, LD50 млекопитающих для E. coli составляет ~0.1—1×106 ПЕ/мл, а в присутствии антибиотиков это число возрастает до ~108 ПЕ/мл. Используя 1-теработ терапевтическую дозу микрофагоцитов, даже такая высокая концентрация бактерий в кровеносной системе, как ~1011 ПЕ/мл (~20% крови при этом будет заражено микроорганизмами объемом ~2 мкм3), может контролироваться микрофагоцитами, что дает суммарную эффективность в ~1000 раз перед естественными фагоцитами. И эта эффективность будет достигнута с помощью наномедицины. С минимальными дополнениями к конструкции микрофагоцит может быть использован для лечения боевой токсемии — распространения в человеческом теле патогенов, вырабатываемых бактериями. Например, у подопытных обезьян наблюдался септический шок с использованием бактерии E. coli с концентрацией 425×106 ПЕ/мл. При этом концентрация патогенного бактериального липополисахарида (ЛПС) в их крови выросла от 0.076 нанограмм/мл (нормальное количество) до максимальной концентрации 1.130 нг/мл [14]. При проведении другого исследования, уровень эндотоксина, в течение бактериальной инфекции, вырос от 0.2 до 2 нг/мл в крови подопытной свиньи [15]. Для устранения ~2 нг/мл ЛПС эндотоксина из крови [16], необходимо изолирование и энзимная переработка ~8×1014 ЛПС молекул из кровяного объема в ~5400 см3, или около ~800 ЛПС молекул на 1 наноустройство, предполагая терапевтическую дозу в 1 теработ модифицированных нанофагоцитов.. Высокая смертность (от 30%-50%) связана с реакцией пациента на ЛПС, которые провоцируют производство цитокинов IL-1beta и IL-6, которые вызывают неконтролируемое воспаление в тканях и дисфункцию органов [17]. Мы уже упоминали, что малые концентрации (~нг/мл) молекул ЛПС производятся бактериями живущими в человеческом теле, однако уничтожение бактерий с помощью антибиотиков оставляет в крови большое количество ЛПС (до ~105 нг/мл [17]). Использование искусственных микрофагоцитов предполагает полное «переваривание» бактерий, включая уничтожение мембранных ЛПС. Поэтому микрофагоциты представляют антимикробную терапию, не производящую септического шока. Если перед внедрением микрофагоцитов в кровь пациента она уже содержит большое количество воспалительных цитокинов, то необходимо произвести первичную противовоспалительную терапию, внедрив в кровь пациента наноустройства класса респироцитов [2] (например, фармацитов [1]) для удаления молекул цитокинов. Такой совместный подход уже обсуждался в [1, 18]. Внутривенная терапевтическая доза фармацитов микронных размеров в размере 1-теработ (каждый наноробот имеет ~105 молекулярных сортирующих роторов и резервуар объемом ~0.5 мкм3 для хранения цитокинов) может понизить содержание цитокинов в крови от ~100 нг/мл [210] (~3×10— 9 молекул/нм3) до нормального уровня ~10 пг/мл [211] (~3×10— 13 молекул /нм3) в течение ~200 секунд, используя для хранения молекул ~0.1% от объема резервуаров наноустройств. Удаление ~105 нг/мл молекул ЛПС займет ~100% объема резервуаров фармацитов. Микрофагоциты будут также полезны при лечении менингитов цереброспинной жидкости и респираторных заболеваний. Нанороботы также могут устранить такие небактериальные патогены, как вирусы, микроскопические паразиты и пр. Вне человеческого тела микрофагоциты могут служить для очищения биологически опасных сред, токсических органических материалов и пр.
|

 Микрофагоцит в крови
Микрофагоцит в крови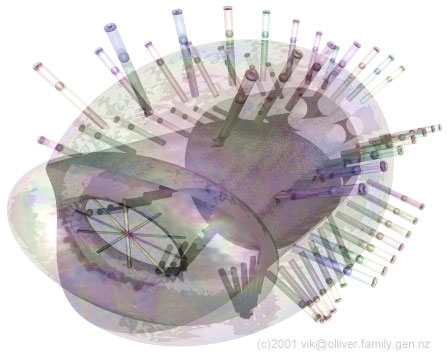 Рис. 1 Предполагаемый вид микрофагоцита (взято из Наномедицинской Галереи Института Предвиденья), автор: Vik Olliver
Рис. 1 Предполагаемый вид микрофагоцита (взято из Наномедицинской Галереи Института Предвиденья), автор: Vik Olliver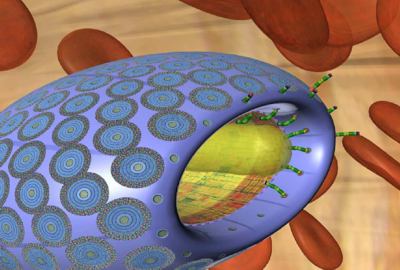 Рис. 2 Микрофагоцит, захватывающий бактерию для фагоцитоза (взято из Наномедицинской Галереи Института Предвиденья), автор: Forrest Bishop
Рис. 2 Микрофагоцит, захватывающий бактерию для фагоцитоза (взято из Наномедицинской Галереи Института Предвиденья), автор: Forrest Bishop Рис. 3 Микрофагоцит по сравнению с эритроцитом (взято из Наномедицинской Галереи Института Предвиденья), автор: Forrest Bishop
Рис. 3 Микрофагоцит по сравнению с эритроцитом (взято из Наномедицинской Галереи Института Предвиденья), автор: Forrest Bishop


