Стандартные окислительно-восстановительные потенциалы
| Элемент
| Полуреакция
| Е 0, В
| | Ag
| Ag+ + 1 ē; = Ag
| +0,80
| | AgCl + 1 ē; = Ag + Cl-
| + 0,22
| | Ag2+ + 1 ē; = Ag+
| + 1,98
| | Ag2О + Н2О + 2 ē; = 2Ag + 2ОН-
| + 0,34
| | 2AgО + Н2О + 2 ē; = Ag2О + 2ОН-
| + 0,607
| | Ag2S + 2 ē; = 2Ag + S2-
| – 0,691
| | Ag2S + 2Н+ + 2 ē; = 2Ag + Н2S
| – 0,0366
| | AgI + 1 ē; = Ag + I-
| – 0,15
| | Al
| AlO  + 2H2O + 3 ē; = Al + 4OH- + 2H2O + 3 ē; = Al + 4OH-
| – 2,35
| | Al(OH)3 + 3 ē; = Al + 4OH-
| – 2,328
| | As
| H3AsO4 + 2H+ + 2 ē; = HAsO2 + 2H2O
| + 0,56
| AsO  + 2H2O + 2 ē; = AsO + 2H2O + 2 ē; = AsO  + 4OH- + 4OH-
| – 0,71
| | Be
| Be2O 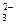 + 3H2O + 4 ē; = 2Be + 6OH- + 3H2O + 4 ē; = 2Be + 6OH-
| – 2,63
| | Bi
| NaBiO3 + 6H+ + 2 ē; = Bi3+ + 3H2O + Na+
| +1,81
| | Br
| BrO3- + 3H2O + 6 ē; = Br-+ 6OH-
| +0,61
| | Br2 + 2 ē; = 2Br-
| +1,09
| | HBrO + H+ + 2 ē; = Br- + H2O
| +1,34
| | Cl
| Cl2 + 2 ē; = 2Cl-
| +1,36
| | ClO3- + 6H+ + 6 ē; = Cl- + 3H2O
| +1,46
| | ClO- + H2O + 2 ē; = Cl- + 2OH-
| +0,92
| | 2ClO- + 2H2O + 2 ē; = Cl2 + 4OH-
| +1,56
| ClO  + 2H2O + 4 ē; = Cl- + 4OH- + 2H2O + 4 ē; = Cl- + 4OH-
| +0,76
| ClO  + H2O + 2 ē; = ClO- + 2OH- + H2O + 2 ē; = ClO- + 2OH-
| +0,66
| ClO  + 8H+ + 8 ē; = Cl- + 4H2O + 8H+ + 8 ē; = Cl- + 4H2O
| +1,389
| ClO  + H2O + 2 ē; = ClO + H2O + 2 ē; = ClO 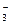 + 2OH- + 2OH-
| +0,36
| | HClO2 + 2H+ + 2 ē; = HClO + H2O
| + 1,645
| | Cr
| Cr2O72- + 14H+ + 6 ē; = 2Cr3+ + 7H2O
| +1,33
| CrO 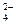 +2H2O + 3 ē; = CrO2- + 4OH- +2H2O + 3 ē; = CrO2- + 4OH-
| - 0,21
| CrO 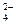 + 4H2O + 3 ē; = Cr3+ + 8OH- + 4H2O + 3 ē; = Cr3+ + 8OH-
| +1,45
| CrO 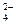 + 8H+ + 3 ē; = Cr3+ + 4H2O + 8H+ + 3 ē; = Cr3+ + 4H2O
| +1,47
| | Cr(OH)3 + 3 ē; = Cr + 3OH-
| – 1,48
| | CrO3 + 6H+ + 3 ē; = Cr3+ + 3H2O
| – 0,11
| CrO 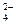 + 4H2O + 3 ē; = Cr(OH)3 + 5OH- + 4H2O + 3 ē; = Cr(OH)3 + 5OH-
| – 0,13
| | H
| 2H2O + 2 ē; = H2 + 2OH-
| – 0,83
| | H2O2 + 2H+ + 2 ē; = 2H2O
| +1,776
| | I
| 2IO3- + 12H+ + 10 ē; = I2 + 6H2O
| +1,195
| | 2IO- + 4H+ + 2 ē; = I2 + 2H2O
| +1,10
| | HIO + H+ + 2 ē; = I- + H2O
| +0,987
| | IO- + H2O + 2 ē; = I- + 2OH-
| +0,485
| IO 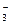 + 6H+ + 6 ē; = I- + 3H2O + 6H+ + 6 ē; = I- + 3H2O
| +1,085
| IO 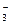 + 2H2O+ 4 ē; = IO- + 4OH- + 2H2O+ 4 ē; = IO- + 4OH-
| +0,15
| IO 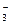 + 3H2O+ 6 ē; = IO- + 6OH- + 3H2O+ 6 ē; = IO- + 6OH-
| +0,26
| | I2 + 2 ē = 2I-
| +0,54
| | 2HIO + 2H+ + 2 ē; = I2 + 2H2O
| +1,439
| | Fe
| Fe(OH)3 + 1 ē; = Fe(OH)2 + OH-
| – 0,56
| | Fe2O3 + 4H+ + 2 ē; = 2FeOH+ + H2O
| +0,16
| | Mn
| MnO2 + 4H+ + 2 ē; = Mn2+ + 2H2O
| +1,24
| MnO  + 8H+ + 5 ē = Mn2+ + 4H2O + 8H+ + 5 ē = Mn2+ + 4H2O
| +1,53
| MnO  + 1 ē; = MnO42- + 1 ē; = MnO42-
| +0,56
| | MnO2 + 4OH- + 2 ē; = Mn2+ + 2H2O
| +1,15
| MnO  + 2H2O + 2 ē; = MnO2 + 4OH- + 2H2O + 2 ē; = MnO2 + 4OH-
| +0,60
| MnO  + 4H+ + 3 ē; = MnO2 + 2H2O + 4H+ + 3 ē; = MnO2 + 2H2O
| +1,679
| MnO  + 2H2O + 3 ē; = MnO2 + 4OH- + 2H2O + 3 ē; = MnO2 + 4OH-
| +0,595
| | Mn(OH)2 + 2 ē; = Mn + 2OH-
| – 1,56
| | Mn(OH)3 + 1 ē; = Mn(OH)2 + OH-
| +0,15
| | Mn2O3 + 6H+ + 2 ē; = 2Mn2+ + 3H2O
| +1,485
| | N
| NO 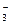 + 2H+ + 1 ē; = NO2 + H2O + 2H+ + 1 ē; = NO2 + H2O
| +0,77
| | N2 + 2H2O + 6H+ + 6 ē; = 2NH4OH
| 0,092
| | 3N2 + 2H+ + 2 ē; = 2HN3
| – 3,09
| N2H  + 3H+ + 2 ē; = 2NH + 3H+ + 2 ē; = 2NH 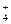
| +1,275
| | N2O + 2H+ + 2 ē; = N2 + H2O
| +1,766
| N2O4 + 2 ē; = 2NO 
| +0,867
| | N2O4 + 2H+ + 2 ē; = 2HNO2
| +1,065
| | N2O4 + 4H+ + 4 ē; = 2NO + 2H2O
| +1,035
| | 2NO + 2H+ + 2 ē; = N2O + H2O
| +1,591
| | 2NO + H2O + 2 ē; = N2O + 2OH-
| +0,76
| | HNO2 + H+ + 1 ē; = NO + H2O
| +0,983
| NO 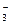 + 3H+ + 2 ē; = HNO2 + H2O + 3H+ + 2 ē; = HNO2 + H2O
| +0,94
| NO 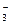 + 2H+ + 2 ē; = NO2- + H2O + 2H+ + 2 ē; = NO2- + H2O
| +0,84
| NO  + H2O + ē; = NO + 2OH- + H2O + ē; = NO + 2OH-
| – 0,46
| NO 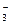 + 4H+ + 3 ē = NO + 2H2O + 4H+ + 3 ē = NO + 2H2O
| +0,96
| 2NO  + 2H2O + 4 ē; = N2O + 2H2O + 4 ē; = N2O  + 4OH- + 4OH-
| – 0,18
| 2NO  + 3H2O + 4 ē; = N2O + 6OH- + 3H2O + 4 ē; = N2O + 6OH-
| +0,15
| 2NO 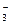 + 2H2O + 2 ē; = N2O4 + 4OH- + 2H2O + 2 ē; = N2O4 + 4OH-
| – 0,85
| 2NO 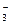 + 4H+ + 2 ē; = N2O4 + 2H2O + 4H+ + 2 ē; = N2O4 + 2H2O
| +0,803
| NO 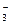 + H2O + 2 ē; = NO + H2O + 2 ē; = NO  + 2OH- + 2OH-
| +0,01
| | О
| O2 + 2H+ + 4 ē; = 4OH-
| +0,40
| | O2 + 2H+ + 2 ē; = H2O2
| +0,69
| | O2 + 4H+ + 4 ē; = 2H2O
| +1,229
| | O2 + 2H2O + 2 ē; = H2O2 + 2OH-
| – 0,146
| | O3 + 2H+ + 2 ē; = H2O + O2
| +2,076
| | O2 + 2H2O + 4 ē; = 4OH-
| +0,40
| | O3 + 2H2O + 2 ē; = O2 + 2OH-
| +1,24
| | P
| H3PO4 + 5H+ + 5 ē; = P + 4H2O
| -0,41
| | H3PO4 + 2H+ + 2 ē; = H3PO3 + H2O
| -0,28
| | Pb
| [Pb(OH)4]2- + 2 ē; = Pb + 4OH-
| -0,52
| | PbO2 + 4H+ + 2 ē; = Pb2+ + 2H2O
| +1,46
| | PbO2 + 2 ē; = PbO22-
| +1,70
| | S
| S + 2 ē; = S2-
| -0,48
| | S + H2О + 2 ē; = HS- + ОН-
| - 0,478
| | SO42- + 10H+ + 8 ē = H2S + 4H2O
| +0,30
| | S + 2H+ + 2 ē; = H2S
| +0,142
| | SO2 + 4H+ + 4 ē; = S + 2H2O
| +0,45
| | SO42-+ 4H+ + 2 ē; = SO2 + 2H2O
| +0,16
| | SO42- + 8H+ + 6 ē; = S + 4H2O
| +0,35
| | SO42- + 8H+ + Cu2+ + 8 ē; = CuS + 4H2O
| +0,42
| | SO42- + 2H+ + 2 ē; = SO32- + H2O
| -0,10
| | Se
| SeO42- + 2H+ + 2 ē = SeO32- + H2O
| +1,15
|

Функция спроса населения на данный товар Функция спроса населения на данный товар: Qd=7-Р. Функция предложения: Qs= -5+2Р,где...
|

Аальтернативная стоимость. Кривая производственных возможностей В экономике Буридании есть 100 ед. труда с производительностью 4 м ткани или 2 кг мяса...
|

Вычисление основной дактилоскопической формулы Вычислением основной дактоформулы обычно занимается следователь. Для этого все десять пальцев разбиваются на пять пар...
|

Расчетные и графические задания Равновесный объем - это объем, определяемый равенством спроса и предложения...
|
Травматическая окклюзия и ее клинические признаки При пародонтите и парадонтозе резистентность тканей пародонта падает...
Подкожное введение сывороток по методу Безредки. С целью предупреждения развития анафилактического шока и других аллергических реакций при введении иммунных сывороток используют метод Безредки для определения реакции больного на введение сыворотки...
Принципы и методы управления в таможенных органах Под принципами управления понимаются идеи, правила, основные положения и нормы поведения, которыми руководствуются общие, частные и организационно-технологические принципы...
|
Конституционно-правовые нормы, их особенности и виды Характеристика отрасли права немыслима без уяснения особенностей составляющих ее норм...
Толкование Конституции Российской Федерации: виды, способы, юридическое значение Толкование права – это специальный вид юридической деятельности по раскрытию смыслового содержания правовых норм, необходимый в процессе как законотворчества, так и реализации права...
Значення творчості Г.Сковороди для розвитку української культури Важливий внесок в історію всієї духовної культури українського народу та її барокової літературно-філософської традиції зробив, зокрема, Григорій Савич Сковорода (1722—1794 pp...
|
|