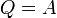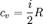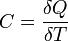РАБОТА В ТЕРМОДИНАМИКЕ. ВЫЧИСЛЕНИЕ РАБОТЫ В ИЗОПРОЦЕССАХ ИГ.
Элементарная работа термодинамической системы над внешней средой может быть вычислена так: · где Работа в термодинамическом процессе · Величина работы зависит от пути, по которому термодинамическая система переходит из состояния 1 в состояние 2, и не является функцией состояния системы. Такие величины называют функциями процесса.
Работа, совершенная идеальным газом в изотермическом процессе, равна В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход. Первый закон термодинамики для изотермического процесса записывается в виде:
16. ТЕПЛОТА. ТЕПЛОЁМКОСТЬ. ОБЩЕЕ ВЫРАЖЕНИЕ ДЛЯ ТЕПЛОЁМКОСТИ. ТЕПЛОЁМКОСТЬ ИГ В ИЗОПРОЦЕССАХ. ТЕПЛОТА, кинетическая часть внутренней энергии вещества, определяемая интенсивным хаотическим движением молекул и атомов, из которых это вещество состоит. Мерой интенсивности движения молекул является температура. Количество теплоты, которым обладает тело при данной температуре, зависит от его массы; например, при одной и той же температуре в большой чашке с водой заключается больше теплоты, чем в маленькой, а в ведре с холодной водой его может быть больше, чем в чашке с горячей водой (хотя температура воды в ведре и ниже).
Теплоёмкость тела (обозначается C) — физическая величина, определяющая отношение бесконечно малого количества теплоты ΔQ, полученного телом, к соответствующему приращению его температуры ΔT: Единица измерения теплоёмкости в системе СИ — Дж/К. Удельной теплоемкостью называется количество теплоты, которое необходимо для нагревания единичного количества вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоемкость, различают массовую, объемную и мольную теплоемкость. Массовая теплоемкость (С) – это количество теплоты, которую необходимо подвести к единице массы тела (обычно 1 кг), чтобы нагреть его на 1 С, измеряется в джоулях на килограмм на кельвин (Дж/кг К). Объемная теплоемкость (С′) – это количество теплоты, которую необходимо подвести к 1 м3 вещества, чтобы нагреть его на 1 С, измеряется в джоулях на кубический метр на кельвин (Дж/м3·К). Мольная теплоемкость (Сμ) – это количество теплоты, которую необходимо подвести к 1 молю вещества, чтобы нагреть его на 1 С, измеряется в джоулях на моль на кельвин (Дж/моль·К). Если же говорить про теплоёмкость произвольной системы, то ее уместно формулировать в терминах термодинамических потенциалов — теплоёмкость есть отношение малого приращения количества теплоты Q к малому изменению температуры T: Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа). Если речь идёт не о каком-либо теле, а о некотором веществе как таковом, то различают удельную теплоёмкость — теплоёмкость единицы массы этого вещества и молярную — теплоёмкость одного моля его. Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объеме равна: R = 8.31 Дж/(моль К) — универсальная газовая постоянная. А при постоянном давлении Удельные теплоёмкости многих веществ приведены в справочниках обычно для процесса при постоянном давлении. К примеру, удельная теплоемкость жидкой воды при нормальных условиях — 4200 Дж/(кг К). Льда — 2100 Дж/(кг К) Теплоёмкость идеального газа Теплоемкость идеального газа - это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло. Теплоемкость идеального газа в изопроцессах
|

 ,
,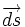 — нормаль элементарной (бесконечно малой) площадки, P — давление и dV — бесконечно малое приращение объёма.
— нормаль элементарной (бесконечно малой) площадки, P — давление и dV — бесконечно малое приращение объёма. , таким образом, выражается так:
, таким образом, выражается так: .
. , где
, где 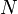 — число частиц газа,
— число частиц газа,  — температура,
— температура,  и
и 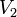 — объём газа в начале и конце процесса,
— объём газа в начале и конце процесса, 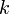 — постоянная Больцмана.
— постоянная Больцмана.