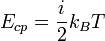Предмет молекулярная физика. Основные положения МКТ и их анализ. Идеальный газ.
Предмет молекулярная физика. Основные положения МКТ и их анализ. Идеальный газ. Область физики, в которой изучаются физические свойства тел в различных агрегатных состояниях на основе рассмотрения их микроскопического (молекулярного) строения, называется молекулярной физикой. В ней рассматриваются следующие вопросы: строение газов, жидкостей и твердых тел, их изменения под действием внешних условий (температуры, давления, электрического и магнитного полей), явления переноса (диффузия, теплопроводность, внутреннеетрение), фазовые превращения (кристаллизация, плавление, испарение, конденсация идр.) поверхностные явления.
Основные положения. А. Авогадро сформулировал два принципа:
Основные положения МКТ
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
2. Статистический и термодинамический методы описания систем многих частиц. Основное уравнение молекулярно–кинетической теории идеального газа. Для исследования физических свойств макроскопических систем, связанных с огромным числом содержащихся в них атомов и молекул, применяют два качественно различных, но взаимно дополняющих друг друга метода: статистический (или молекулярно-кинетический) и термодинамический. молекулярной физики — раздела физики, изучающего строение и свойства вещества исходя из молекулярно-кинетических представлений. термодинамики — раздела физики, изучающего общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Это уравнение, связывающее макроскопический параметр состояния газа – его давление – с микроскопическими параметрами газа – массой молекулы, концентрацией молекул и их средней квадратичной скоростью: давление пропорционально массе молекулы, их концентрации и квадрату средней квадратичной скорости. Коэффициент пропорциональности равен 1/3
3. Модель идеального газа. Давление. Основное уравнение МКТ (вывод).
Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём. Обозначим скорость движения vx, тогда перед столкновением со стенкой сосуда импульс частицы равен mvx, а после - − mvx, поэтому стенке передается импульс p = 2mvx. Время, через которое частица сталкивается с одной и той же стенкой, равно
Отсюда следует:
Так как давление
Подставив, получим:
Преобразовав:
Так как рассматривается кубический сосуд с ребром длиной l, то S = l2
Отсюда:
Соответственно,
Таким образом, для большого числа частиц верно следующее:
Поскольку
Отсюда
или
Пусть
Температура. Молекулярно-кинетический смысл температуры. Основные понятия термометрии.
Температура — физическая величина, примерно характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия. В Международной системе единиц (СИ) термодинамическая температура выражается в кельвинах, температура Цельсия — в градусах [1]. На практике часто применяют градусы Цельсия из-за привязки к важным характеристикам воды — температуре таяния льда (0° C) и температуре кипения (100° C). Это удобно, так как большинство климатических процессов, процессов в живой природе и т. д. связаны с этим диапазоном. Температура с молекулярно-кинетической точки зрения — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Связь между кинетической энергией, массой и скоростью выражается следующей формулой: Таким образом, частицы одинаковой массы и значения скорости имеют одну и ту же температуру.
Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана: где: i — число степеней свободы kB = 1.380 6505(24) × 10-23 Дж/K — постоянная Больцмана T — температура;
|

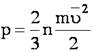
 .
.
 , следовательно сила F = p * S
, следовательно сила F = p * S

 .
. и
и  .
. , аналогично для осей y и z.
, аналогично для осей y и z. , то
, то  . Это следует из того, что все направления движения молекул в хаотичной среде равновероятны.
. Это следует из того, что все направления движения молекул в хаотичной среде равновероятны.
 .
.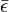 — средняя кинетическая энергия молекул, а Ek — полная кинетическая энергия всех молекул, тогда:
— средняя кинетическая энергия молекул, а Ek — полная кинетическая энергия всех молекул, тогда:  , откуда
, откуда 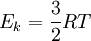 .
.