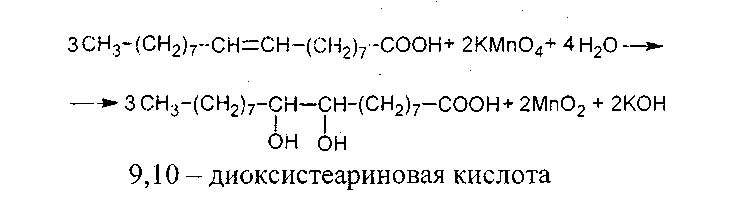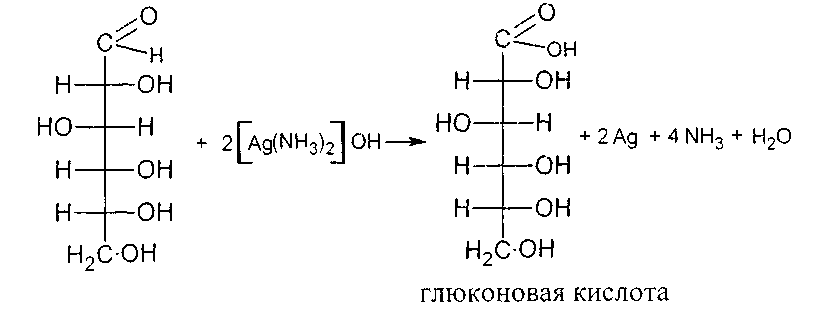a) Взаимодействие муравьиной кислоты с аммиачным раствором гидроксида серебра (реакция серебряного зеркала). В молекуле муравьиной кислоты НСООН имеется альдегидная группа, поэтому открыть ее в растворе можно реакциями, характерными для альдегидов, например реакцией серебряного зеркала.
Готовят в пробирке аммиачный раствор арґентум (Ι)гидроксида. Для этого к 1 - 2 мл 1-процентного раствора арґентум (Ι) нитрата добавляют 1 - 2 капли 10-процентного раствора натрий гидроксида, образовавшийся осадок арґентум (Ι) оксида растворяют, добавляя по каплям 5-процентный раствор аммиака. К полученному прозрачному раствору добавляют 0,5 мл муравьиной кислоты. Пробирку с реакционной смесью нагревают несколько минут в водяной бане (температура воды в бане 600-700 С). Металлическое серебро выделяется в виде зеркального налета на стенках пробирки или в виде темного осадка.
НСООН+2Ag[(NH3)2]ОН → CO2 + H2O+2Ag+ 4NH3
б) Окисление муравьиной кислоты калий перманганатом. В пробирку помещают примерно 0,5г муравьиной кислоты или ее соли, 0,5 мл 10- процентного раствора сульфатной кислоты и 1мл 5-процентного раствора калий перманганата. Пробирку закрывают пробкой с газоотводной трубкой, конец которой опускают в другую пробирку с 2мл известковой (или баритовой) воды, и нагревают реакционную смесь.
5НСООН+2KMnO4+3H2SO4→ 5CO2+8H2O+K2SO4+2MnSO4
в) Разложение муравьиной кислоты при нагревании с концентрированной серной кислотой. (Тяга!) В сухую пробирку вносят 1 мл муравьиной кислоты или 1 г ее соли и 1 мл концентрированной сульфатной кислоты. Пробирку закрывают пробкой с газоотводной трубкой и осторожно нагревают. Муравьиная кислота разлагается с образованием карбон (II) оксида и воды. Карбон (II) оксид поджигают у отверстия газоотводной трубки. Обратите внимание на характер пламени.
После окончания работы пробирку с реакционной смесью необходимо охладить, чтобы прекратить выделение ядовитого угарного газа.

Опыт 12. Взаимодействие стеариновой и олеиновой кислот со щелочью.
В сухой пробирке растворяют примерно 0,5 г стеарина в диэтиловом эфире (без нагревания) и добавляют 2 капли 1-процентного спиртового раствора фенолфталеина. Затем по каплям приливают 10-процентный раствор натрий гидроксида. Появляющаяся вначале малиновая окраска исчезает при встряхивании.
Напишите уравнение реакции стеариновой кислоты с натрий гидроксидом. (Стеарин представляет собой смесь стеариновой и пальмитиновой кислот.)
С17H35COOH + NaOH → С17H35COONa + H2O
натрий стеарат
(мыло)
Повторяют опыт, используя 0,5 мл олеиновой кислоты
С17H33COOH+NaOH→С17H33COONa+Н2О
олеат натрия
Опыт13. Отношение олеиновой кислоты к бромной воде и раствору перманганата калия.
а) Реакция олеиновой кислоты с бромной водой В пробирку наливают 2 мл воды и вносят около 0,5 г олеиновой кислоты. Смесь энергично взбалтывают.

б) Окисление олеиновой кислоты калий перманганатом. В пробирку помещают 1 мл 5-процентного раствора калий перманганата, 1мл 10-процентного раствора натрий карбоната и 0,5 мл олеиновой кислоты. Смесь энергично перемешивают. Отмечают изменения, происходящие с реакционной смесью.
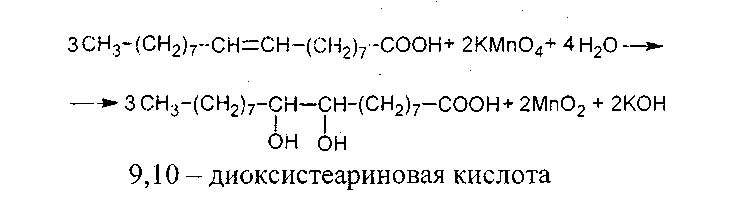
Опыт 14. Возгонка бензойной кислоты.
Возгонку малых количеств бензойной кислоты ведут в фарфоровой чашке, закрытой широким концом конической воронки (см. рис. 1), диаметр которой несколько меньше диаметра чашки.
Носик воронки закрепляют в лапке штатива и плотно закрывают ватой, а для того, чтобы возгон не попадал обратно в чашку, ее прикрывают круглым листком фильтровальной бумаги с несколькими отверстиями в нем. Фарфоровую чашку с мелкими кристаллами бензойной кислоты (tпл =122,40 С; возгоняется ниже tпл) осторожно медленно нагревают на небольшом пламени газовой горелки (на асбестовой сетке). Можно охладить верхнюю воронку, прикладывая смоченный холодной водой кусочек фильтровальной бумаги. После прекращения возгонки (через 15 - 20 мин) сублимат осторожно переносят шпателем в склянку.

Примечание. Для проведения работы, бензойную кислоту можно загрязнить песком.
Пробирку, в которой образовалась эмульсия, закрывают пробкой с обратным холодильником, нагревают в водяной бане до начинающегося кипения и встряхивают. Увеличивается ли растворимость масла при нагревании?
Опыт повторяют, но вместо подсолнечного масла в пробирки с органическими растворителями вносят небольшое количество животного жира (свиного, говяжьего или бараньего сала),
б) Определение степени непредельности жира реакцией с бромной водой. (Тяга!) В пробирку наливают 0.5 мл подсолнечного масла и 3 мл бромной воды. Содержимое пробирки энергично взбалтывают. Что происходит с бромной водой?
в) Взаимодействие растительного масла с водным раствором калий перманганата (реакция Е. Е. Вагнера). В пробирку наливают примерно 0,5 мл подсолнечного масла, 1 мл 10-процентного раствора карбоната натрия и 1 мл 2-процентного раствора калий перманганата. Энергично встряхивают содержимое пробирки. Фиолетовая окраска калий перманганата исчезает.
Обесцвечивание бромной воды и реакция с водным раствором калий перманганата - качественные реакции на присутствие кратной связи (ненасыщенность) в молекуле органического вещества.
г) Омыление жира спиртовым раствором натрий гидроксида В коническую колбу емкостью 50 - 100 мл помещают 1.5 - 2 г твердого жира и приливают 6 мл 15-процентного спиртового раствора натрий гидроксида. Колбу закрывают пробкой с воздушным холодильником, перемешивают реакционную смесь и нагревают колбу в водяной бане при встряхивании в течение 10 – 12 мин (температура воды в бане около 800С). Для определения конца реакции несколько капель гидролизата выливают в 2-3 мл горячей дистиллированной воды: если гидролизат растворяется полностью, без выделения капель жира, то реакцию можно считать законченной. После окончания омыления из гидролизата высаливают мыло добавлением 6 - 7 мл горячего насыщенного раствора натрий хлорида. Выделяющееся мыло всплывает, образуя на поверхности раствора слой. После отстаивания смесь охлаждают холодной водой, затвердевшее мыло отделяют.
Химизм процесса на примере тристеарина:

Опыт 17. Сравнение свойств мыла и синтетических моющих средств
а) Отношение к фенолфталеину. Налейте в одну пробирку 2-3 мл 1-процентного раствора хозяйственного мыла, в другую - столько же 1- процентного раствора синтетического стирального порошка. Добавьте в обе пробирки по 2-3 капли раствора фенолфталеина. Можно ли использовать данные моющие средства для стирки тканей, чувствительных к щелочам?
б) Отношение к кислотам. К растворам мыла и стирального порошка в пробирках добавьте насколько капель 10-процентного раствора кислоты (хлоридной или сульфатной). Образуется ли пена при встряхивании? Сохраняются ли моющие свойства исследуемых средств в кислой среде?
C17H35COONa+HCl→C17H35COOH↓+NaCl
в) Отношение ккальций хлориду. К растворам мыла и стирального порошка в пробирках добавляют по 0,5 мл 10-процентного раствора кальций хлорида. Встряхивают содержимое пробирок. Образуется ли при этом пена? Можно ли использовать данные средства для стирки в жесткой воде?
C17H35COONa+CaCl2→Ca(C17H35COO)2↓+2NaCl
Опыт 18. Взаимодействие глюкозы с аммиачным раствором аргентум (Ι) оксида (реакция серебряного зеркала).
В пробирку наливают 0.5 мл 1-процентного раствора аргентум(Ι) нитрата, 1 мл 10-процентного раствора натрий гидроксида и приливают по каплям 5-процентный раствор аммиака до растворения образовавшегося осадка аргентум (Ι) гидроксида. Затем добавляют 1 мл 1-процентного раствора глюкозы и нагревают содержимое пробирки 5 - 10 мин в водяной бане при 700 – 800 С. Металлическое серебро выделяется на стенках пробирки в виде зеркального налета. Во время нагревания пробирки нельзя встряхивать, иначе металлическое серебро выделится не на стенках пробирок, а в виде темного осадка. Чтобы получить хорошее зеркало, в пробирках предварительно кипятят 10-процентный раствор натрий гидроксида, затем их споласкивают дистиллированной водой.
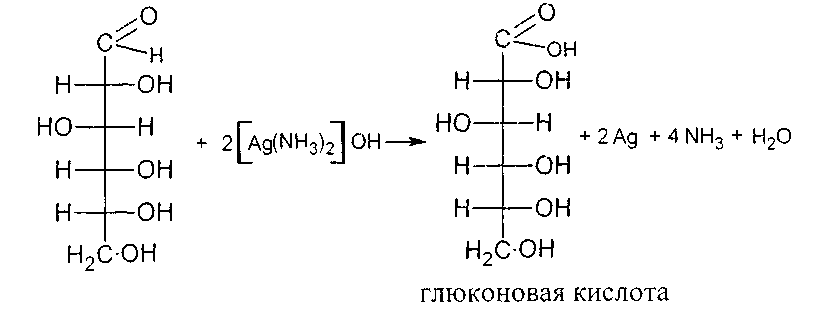
В пробирку наливают 3 мл 1-процентного раствора сахарозы и прибавляют 1 мл 10-процентного раствора серной кислоты. Полученный раствор кипятят в течение 5 мин, затем охлаждают и нейтрализуют сухим гидрокарбонатом натрия, добавляя его небольшими порциями при перемешивании (осторожно, жидкость вспенивается от выделяющегося оксида углерода (IY)). После нейтрализации (когда прекратится выделение СО2) приливают равный объем реактива Фелинга и нагревают верхнюю часть жидкости до начинающегося кипения.
Изменяется ли окраска реакционной смеси?
В другой пробирке нагревают смесь 1,5 мл 1-процентного раствора сахарозы с равным объемом реактива Фелинга. Сравнивают результаты опыта – реакцию сахарозы с реактивом Фелинга до гидролиза и после гидролиза.
Н2SО4
С12Н22О11 + Н2О С6Н12О6 + С6Н12О6
глюкоза фруктоза
Примечание. В условиях школьной лаборатории реактив Фелинга можно заменить купрум (ΙΙ)гидроксидом.
Опыт 20. Гидролиз целлюлозы.
В сухую коническую колбу емкостью 50 – 100 мл помещают немного очень мелко нарезанных кусочков фильтровальной бумаги (целлюлозы) и смачивают их концентрированной сульфатной кислотой. Тщательно перемешивают содержимое колбы стеклянной палочкой до полного разрушения бумаги и образования бесцветного вязкого раствора. После этого к нему добавляют небольшими порциями при перемешивании 15 – 20 мл воды (осторожно!), колбу соединяют с воздушным обратным холодильником и кипятят реакционную смесь 20 – 30 мин, перемешивая ее периодически. После окончания гидролиза отливают 2 – 3 мл жидкости, нейтрализуют ее сухим натрий карбонатом, добавляя его небольшими порциями (жидкость вспенивается), и обнаруживают присутствие восстанавливающих сахаров реакцией с реактивом Фелинга или купрум (ΙΙ) гидроксидом.
(C6H10O5)n+nH2O→nC6H12O6
Целлюлоза глюкоза
Опыт 21. Взаимодействие глюкозы с купрум (ΙΙ) гидроксидом.
а) В пробирку помещают 2 мл 1-процентного раствора глюкозы и 1 мл 10-процентного натрий гидроксида. К полученной смеси добавляют 1 - 2 капли 5-процентного раствора купрум (ΙΙ) сульфата и встряхивают содержимое пробирки. Образующийся вначале голубоватый осадок купрум (ІІ) гидроксида мгновенно растворяется, получается синий прозрачный раствор купрум (ΙΙ) сахарата.
Химизм процесса (упрощенно): -

б) Содержимое пробирки нагревают над пламенем горелки, держа пробирку наклонно так, чтобы нагревалась только верхняя часть раствора, а нижняя оставалась без нагрева (для контроля). При осторожном нагревании до кипения, нагретая часть синего раствора окрашивается в оранжево-желтый цвет вследствие образования купрум (Ι) гидроксида. При более продолжительном нагревании может образоваться осадок купрум (Ι)оксида.

Опыт 22. Взаимодействие сахарозы с гидроксидами металлов.
а) Реакция с купрум (ΙΙ) гидроксидом) в щелочной среде. В пробирке смешивают 1,5 мл 1-процентного раствора сахарозы и 1,5 мл 10-процентного раствора натрий гидроксида. Затем по каплям добавляют 5-процентный раствор купрум (ΙΙ) сульфата. Образующийся вначале бледно-голубой осадок купрум (ΙΙ) гидроксида при встряхивании растворяется, раствор приобретает сине-фиолетовую окраску вследствие образования комплексного купрум (ΙΙ) сахарата.
б) Получение кальций сахарата. В небольшой стакан (25 — 50 мл) наливают 5 — 7 мл 20-процентного раствора сахарозы и по каплям при перемешивании добавляют свежеприготовленное известковое молоко. Кальций гидроксид растворяется в растворе сахарозы. Способность сахарозы давать растворимые сахараты кальция используется в промышленности для очистки сахара при выделении его из сахарной свеклы.
в) Специфические цветные реакции. В две пробирки наливают по 2 — 5 мл 10-процентного раствора сахарозы и по 1 мл 5-процентного раствора натрий гидроксида. Затем в одну пробирку добавляют несколько капель 5- процентного раствора кобальт (ΙΙ) сульфата, в другую — несколько капель 5- процентного раствора никель (ΙΙ) сульфата. В пробирке с солью кобальта появляется фиолетовое окрашивание, а с солью никеля — зеленое,
Опыт2З. Взаимодействие крахмала с йодом.
В пробирку наливают 1 мл 1 -процентного раствора крахмального клейстера и затем добавляют несколько капель сильно разбавленного водой йода в калий йодиде. Содержимое пробирки окрашивается в синий цвет. Полученную темно-синюю жидкость нагревают до кипения. Окраска при этом исчезает, но при охлаждении появляется вновь. Крахмал является неоднородным соединением. Он представляет собой смесь двух полисахаридов — амилозы (20%) и амилопектина (80%). Амилоза растворима в теплой воде и дает с йодом синее окрашивание. Амилоза состоит из почти неразветвленных цепей глюкозных остатков, обладающих структурой винта или спирали (примерно 6 глюкозных остатков в одном винте). Внутри спирали остается свободный канал диаметром около 5 мк, в который внедряются молекулы йода, образуя окрашенные комплексы. При нагревании эти комплексы разрушаются. Амилопектин в теплой воде не растворим, набухает в ней, образуя крахмальный клейстер. В его состав входят разветвленные цепи глюкозных остатков. Амилопектин с йодом дает красновато-фиолетовое окрашивание, обусловленное адсорбцией молекул йода на поверхности боковых цепей.
Опыт 24. Гидролиз крахмала.
а) Кислотный гидролиз крахмала.
В коническую колбу емкостью 50 мл наливают 20 — 25 мл 1-процентного крахмального клейстера и 3 — 5 мл 10-процентного раствора сульфатной кислоты. В 7 — 8 пробирок наливают по 1 мл очень разбавленного раствора йода в калий йодиде (светло-желтого цвета), пробирки ставят в штатив. В первую пробирку вносят 1 – 3 капли подготовленного для опыта раствора крахмала. Отмечают образовавшуюся окраску. Затем колбу нагревают на асбестовой сетке небольшим пламенем горелки. Через 30 секунд после начала кипения отбирают пипеткой вторую пробу раствора, которую вносят во вторую пробирку с раствором йода, после встряхивания отмечают цвет раствора. В дальнейшем отбирают пробы раствора через каждые 30 секунд и вносят их в последующие пробирки с раствором йода. Отмечают постепенное изменение окраски растворов при реакции с йодом. Изменение окраски происходит в следующем порядке, см. табл.
| Номер пробы
| Окраска с йодом
|
|
| Синяя
|
|
| Сине-фиолетовая
|
|
| Красно-фиолетовая
|
|
| Красновато-бурая
|
|
| Оранжевая
|
|
| Оранжевато-желтая
|
|
| Желтая (цвет йода)
|
После того как реакционная смесь перестанет давать окраску с йодом, смесь кипятят еще 2 - З мин после чего ее охлаждают и нейтрализуют 10 – процентным раствором натрий гидроксида, добавляя его по каплям до щелочной реакции среды (появления розовой окраски на фенолфталеиновой индикаторной бумаге).
Часть щелочного раствора переливают в пробирку, смешивают с равным объемом реактива Фелинга или свежеприготовленной суспензией купрум (ΙΙ) гидроксида и нагревают верхнюю часть жидкости до начинающегося кипения.
(С
6Н
10О
5)n (С
6Н
10О
5)x (С
6Н
10О
5)y
n/2 С12Н22O11 nС6Н12О6
б) Ферментативный гидролиз крахмала.
Хорошо разжевывают маленький кусочек черного хлеба и помещают его в пробирку. Вносят в нее несколько капель 5 - процентного раствора купрум (ΙΙ) сульфата и 05 — 1 мл 10-процентного раствора натрий гидроксида. Пробирку с содержимым нагревают.
Задание 3. Отработать технику и разработать методику демонстрационных опытов по получению и изучению свойств нитрогенсодержащих органических веществ.
Оборудование: химические стаканы, стеклянная палочка, пробирки, колба Вюрца, капельная воронка, химический стакан, стеклянные газоотводные трубки, соединительные резиновые трубки, лучинка.
Реактивы: анилин, метиламин, растворы лакмуса и фенолфталеина, концентрированная хлоридная кислота, раствор натрий гидроксида(10 %), раствор хлорной извести, концентрированная сульфатная кислота, концентрированная нитратная кислота, яичный белок, раствор медного купороса, плюмбум (ΙΙ) ацетат, раствор фенола, формалин.
Опыт 1. Получение метиламина.
В колбу Вюрца объемом 100 — 150 мл внести 5-7 г метиламин хлорида и закрыть пробкою со вставленной в нее капельной воронкой. Газоотводную трубку соединить резиновой трубкой со стеклянным наконечником и опустить в стакан с водой. Из воронки каплями добавлять раствор калий гидроксида (50 %). Смесь в колбе осторожно нагреть. Происходит разложение соли и выделение метиламина, который легко распознать по характерному запаху, который напоминает запах аммиака. Метиламин собирается на дне стакана под слоем воды:
[H3C – NH3]+Cl-+KOH → H3C – NH2+KCl+H2O
Опыт 2. Горение метиламина.
Метиламин на воздухе горит бесцветным пламенем. К отверстию газоотводной трубки прибора, описанного в предыдущем опыте, поднести горящую лучинку и наблюдать горение метиламина:
4H
3C – NH
2+9O
2 → 4CO
2+10 H
2O+2N
2
Опыт 3. Отношение метиламина к индикаторам.
Полученный метиламин пропустить в пробирку, заполненную водой и одним из индикаторов. Лакмус синеет, а фенолфталеин становится малиновым:
H3C – NH2+H – OH → [H3C – NH3+]OH
Это свидетельствует об основных свойствах метиламина.
Опыт 4. Образование солей метиламином.
а) К отверстию пробирки, из которой выделяется газообразный метиламин, подносят стеклянную палочку, смоченную концентрированной хлоридной кислотой. Палочка окутывается туманом.
H3C – NH2+HCl → [H3C – NH3]+Cl-
б) В две пробирки наливают по 1 — 2 мл: в одну — З-процентный раствор ферум (III) хлорида, в другую 5-процентный раствор купрум (ΙΙ)сульфата. В каждую пробирку пропускают газообразный метиламин. В пробирке с раствором ферум (III) хлорида выпадает бурый осадок, а в пробирке с раствором купрум (ΙΙ) сульфата образующийся вначале осадок голубого цвета растворяется с образованием комплексной соли, окрашенной в ярко-синий цвет.
Химизм процессов:
3[H3C – NH3]+OH-+FeCl3 → Fe(OH)↓+3[H3C – NH3]+Cl-
2[H3C – NH3]+OH-+CuSO4→Cu(OH)2↓+[H3C – NH3]+SO4-
4[H3C – NH3]+OH-+ Cu(OH)2→[Cu(H3CNH2)4](OH)2+4H2O
Опыт 5. Взаимодействие анилина с хлоридной кислотой.
В пробирку с 5 мл анилина прилить столько же концентрированной хлоридной кислоты. Пробирку охладить в холодной воде. Выпадает осадок анилин гидроген хлорида. В пробирку с твердым гидроген хлоридным анилином прилить немного воды. После перемешивания, анилин гидроген хлорида растворяется в воде.
C6H5 – NH2 + HCl → [C6H5 – NH3+]Cl-
Опыт 6. Взаимодействие анилина с бромной водой.
К 5 мл воды прилить 2 -З капли анилина и смесь сильно встряхнуть. К полученной эмульсии по каплям прибавить бромную воду. Смесь обесцвечивается, и выпадает белый осадок триброманилина.

Опыт 7. Окрашивание ткани анилиновым красителем.
Крашение шерсти и шелка кислотными красителями. Растворяют 0,1 г метилового оранжевого в 50 мл воды. Раствор разливают в 2 стакана. В один из них добавляют 5 мл 4н раствора сульфатной кислоты. Затем в оба стакана опускают кусочки белой шерстяной (или шелковой) ткани. Растворы с тканью кипятят 5 мин. Затем ткань вынимают, промывают водой, выжимают и высушивают на воздухе, развесив на стеклянных палочках. Обратите внимание на различие в интенсивности окраски кусочков ткани.
Как влияет кислотность среды на процесс окраски ткани?
Опыт 8. Доказательство наличия функциональных групп в растворах аминокислот.
а) Обнаружение карбоксильной группы.
К 1 мл 0,2-процентного раствора натрий гидроксида, окрашенного фенолфталеином в розовый цвет, прибавляют по каплям 1 - процентный раствор аминоацетатной кислоты (глицина) до обесцвечивания смеси
HOOC – CH2 – NH2 + NaOH → NaOOC – CH2 – NH2 + H2O
б) Обнаружение аминогруппы.
К 1 мл 0,2-процентного - раствора хлоридной кислоты, окрашенного индикатором конго в синий цвет (кислая среда), прибавляют по каплям 1- процентный раствор глицина до изменения окраски смеси на розовую (нейтральная среда):
HOOC – CH2 – NH2+HCl → [HOOC – CH2 – NH3+]Cl-
Опыт 9. Действие аминокислот на индикаторы.
В пробирку внести 0,3 г глицина и добавить 3 мл воды. Раствор разлить на три пробирки. В первую пробирку добавить 1 - 2 капли метилоранжа, во вторую - столько же раствора фенолфталеина, в третью — раствор лакмуса. Окраска индикаторов не меняется, что объясняется наличием в молекуле глицина кислотной (—СООН) и основной (—NH2) групп, которые взаимно нейтрализуются.
Опыт 10. Осаждение белков.
а) В две пробирки с раствором белка добавить по каплям растворы медного купороса и плюмбум (ΙΙ) ацетата. Образуются хлопьевидные осадки, растворяющиеся в избытке растворов солей.
б) В две пробирки с раствором белка добавляют равные объемы растворов фенола и формалина. Наблюдать осаждение белка.
в) Нагреть раствор белка в пламени горелки. Наблюдать помутнение раствора, что обусловлено разрушением гидратных оболочек возле частичек белка и увеличение их.
Опыт 11. Цветные реакции белков.
а) Ксантопротеиновая реакция.
К 1 мл белка добавить 5- 6 капель концентрированной нитратной кислоты. При нагревании раствор и осадок окрашивается в ярко-желтый цвет.
б) Биуретовая реакция.
К 1 — 2 мл раствора белка добавить столько же разбавленного раствора медного купороса. Жидкость окрашивается в красно-фиолетовый цвет. Биуретовая реакция дает возможность выявить в молекуле белка пептидную связь.
Ксантопротеиновая реакция происходит только в том случае, если в молекулах белка содержатся остатки ароматических аминокислот (фенилаланин, тирозин, триптофан).
Опыт 12. Реакции с карбамидом.
а) Растворимость мочевины в воде.
В пробирку помещают 0,5 г кристаллической мочевины и постепенно добавляют воду до полного растворения мочевины. По капле полученного раствора наносят на красную и синюю лакмусовую бумагу. Какую реакцию (кислую, нейтральную или щелочную) имеет водный раствор мочевины?
В водном растворе мочевина находится в виде двух таутомерных форм:

б) Гидролиз мочевины.
Как и все амиды кислот, мочевина легко гидролизуется в кислой и в щелочной средах.
Наливают в пробирку 1 мл 20-процентного раствора мочевины и добавляют 2 мл прозрачной баритовой воды. Раствор кипятят до появления в пробирке осадка барий карбоната. Выделяющийся из пробирки аммиак обнаруживают по посинению влажной лакмусовой бумаги.
H2N – C – NH2+2H2O→2NH3+[ HO – C – OH]→CO2
→Н
2О

Ba(OH)2+ CO2→BaCO3↓+ H2O
в) Образование биурета.
В сухой пробирке нагревают 0,2 г мочевины. Сначала мочевина плавится (при 133 С), затем при дальнейшем нагревании разлагается с выделением аммиака. Аммиак обнаруживают по запаху (осторожно!) и по посинению влажной красной лакмусовой бумаги, поднесенной к отверстию пробирки. Через некоторое время расплав в пробирке затвердевает, несмотря на продолжающееся нагревание:

Пробирку охлаждают,добавляют в нее 1 -2 мл воды и при слабом нагревании растворяют биурет. В расплаве, кроме биурета, содержится некоторое количество труднорастворимой в воде циануровой кислоты, поэтому раствор получается мутным. Когда осадок отстоится, сливают с него раствор биурета в другую пробирку, добавляют несколько капель 10-процентного раствора натрий гидроксида (при этом раствор становится прозрачным) и 1-2 капли 1- процентного раствора купрум (ΙΙ)сульфата. Раствор окрашивается в розово-фиолетовый цвет. Избыток купрум (ΙΙ) сульфата маскирует характерное окрашивание, вызывая посинение раствора, поэтому его следует избегать.
Опыт 13. Функциональный анализ органических веществ.
1. Качественный элементарный анализ органических соединений. Наиболее распространенными элементами в органических соединениях, кроме Карбона, являются Гидроген, Оксиген, Нитроген, галогены, Сульфур, Фосфор. Обычные методы качественного анализа неприменимы для анализа органических соединений. Для обнаружения Карбона, Нитрогена, Сульфура и других элементов органическое вещество разрушают путем сплавления с натрием, при этом исследуемые элементы переходят в неорганические соединения. Например, Карбон переходит в карбон (IУ) оксид, Гидроген - в воду, Нитроген - в натрий цианид, Сульфур - в натрий сульфид, галогены — в натрий галогениды. Далее открывают элементы обычными методами аналитической химии.
1. Обнаружение Карбона и Гидрогена окислением вещества купрум(II) оксидом.

Прибор для одновременного обнаружения Карбона и Гидрогена в органическом веществе:
1 – сухая пробирка со смесью сахарозы и купрум (II) оксидом;
2 – пробирка с известковой водой;
3 – вата;
4 – безводный купрум (ΙΙ) сульфат.
Наиболее общим, универсальным методом обнаружения в органическом веществе. углерода и одновременно с ним водорода является окисление купрум (II) оксидом. При этом Карбон превращается в карбон (IУ) оксид, а Гидроген - в воду.
В сухую пробирку с газоотводной трубкой (рис. 2) помещают 0,2 — 0,3 г сахарозы и 1 - 2 г порошка купрум (II) оксида. Содержимое пробирки тщательно перемешивают, сверху смесь засыпают слоем купрум (II) оксида - примерно 1 г. В верхнюю часть пробирки (под пробку) помещают маленький кусочек ваты, накоторую насыпают немного безводного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой и закрепляют ее в лапке штатива с небольшим наклоном в сторону пробки. Свободный конец газоотводной трубки опускаю в пробирку с известковой (или баритовой) водой так, чтобы, трубка почти касалась поверхности жидкости. Сначала нагревают всю пробирку, затем сильно нагревают ту часть, где находится реакционная смесь.
Отметьте, что происходит с известковой водой. Почему изменяется цвет купрум (ΙΙ) сульфата?
Химизм процессов:
C12H22O11+24CuO→12CO2+11H2O+24Cu
Ca(OH)2+CO2→CaCO3↓+H2O
CuSO4+5H2O→CuSO4 ∙ 5H2O
2. Проба Бейльштей на на галогены.
При прокаливании органического вещества с купрум (II) оксидом происходит его окисление. Карбон превращается в карбон(ІУ) оксид, Гидроген — в воду, а галогены (кроме флуора) образуют с Купрумом летучие галогениды, которые окрашивают пламя в ярко-зеленый цвет. Реакция очень чувствительна. Однако следует иметь в виду, что и некоторые другие соли купрума, например цианиды, образующиеся при прокаливании нитргенсодержащих органических соединений (мочевины, производных пиридина, хинолина и др.), также окрашивают пламя.
Медную проволоку держат за пробку и прокаливают другой конец ее (петлю) в пламени горелки до прекращения окрашивания пламени и образования на поверхности черного налета купрум(II) оксида. Остывшую петлю смачивают хлороформом, налитым в пробирку, и снова вводят в пламя горелки. Сначала пламя становится светящимся (сгорает Карбон), затем появляется интенсивное зеленое окрашивание.
2Cu+O2→2CuO
2CH – Cl3+5CuO→CuCl2+4CuCl+2CO2+H2O
Следует сделать контрольный опыт, используя вместо хлороформа вещество, не содержащее галоген (бензол, воду, спирт).
Для очистки проволоку смачивают хлоридной кислотой и прокаливают.
II. Открытие функциональных групп.
На основании предварительного анализа (физические свойства, элементный анализ) можно ориентировочно определить класс, к которому принадлежит
данное исследуемое вещество. Эти предположения подтверждают качественными реакциями на функциональные группы.
1. Качественные реакции на кратные карбон - карбоновые связи.
а) присоединение брома. Углеводороды, содержащие двойные и тройные связи, легко присоединяют бром:

К раствору 0,1 г (или 0,1 мл) вещества в 2 — З мл четыреххлористого карбона или хлороформа добавляют по каплям при встряхивании 5-процентный раствор брома в том же растворителе. Мгновенное исчезновение окраски брома свидетельствует о наличии кратной связи в веществе. Но раствор брома также обесцвечивается соединениями, содержащими подвижный Гидроген (фенолы, ароматические амины, третичные углеводороды). Однако при этом происходит реакция замещения с выделением гидроген бромида, присутствие которого легко обнаружить с помощью влажной бумажки синего лакмуса или конго.
б) Проба с калий перманганатом. В слабощелочной среде при действии калий перманганата происходит окисление вещества с разрывом кратной связи, раствор при этом обесцвечивается, и образуется хлопьевидный осадок MnO2- манган (IУ) оксид.
К 0,1 г (или 0,1 мл) вещества, растворенного в воде или ацетоне, добавляют по каплям при встряхивании 1-процентный раствор калий перманганата. Происходит быстрое исчезновение малиново-фиолетовой окраски, и появляется бурый осадок MnO2. Однако калий перманганат окисляет вещества других классов: альдегиды, многоатомные спирты, ароматические амины. При этом также обесцвечиваются растворы, но окисление протекает большей частью значительно медленнее.
2. Обнаружение ароматических систем.
Ароматические соединения в отличие от алифатических соединений способны легко вступать в реакции замещения, часто образуя окрашенные соединения. Обычно для этого используют реакцию нитрования и алкилирования.
Нитрование ароматических соединений. (‘Осторожно! Тяга!,) Нитрование проводят азотной кислотой или нитрующей смесью:
R – H + HNO3 → RNO2 + H2O
В пробирку помещают 0,1 г (или 0,1 мл) вещества и при непрерывном встряхивании постепенно прибавляют З мл нитрующей смеси (1 часть концентрированной нитратной кислоты и 1 часть концентрированной сульфатной кислоты). Пробирку закрывают пробкой с длинной стеклянной трубкой, которая служит обратным холодильником, и нагревают на водяной бане 5 мин при 500 С. Смесь выливают в стакан с 10 г измельченного льда. Если при этом выпадает твердый продукт или масло, нерастворимые в воде и отличающиеся от исходного вещества, то можно предположить присутствие ароматической системы.
3. Качественные реакции спиртов.
При анализе на спирты используют реакции замещения как подвижного гидрогена в гидроксильной группе так и всей гидроксильной группы.
а) Реакция с металлическим натрием.
Спирты легко реагируют с натрием, образуя при этом алкоголяты, растворимые в спирте:
2 R – OH + 2 Na → 2 RONa + H2
В пробирку помещают 0,2 - 0,3 ‘мл безводного исследуемого вещества и осторожно добавляют маленький кусочек металлического натрия величиной с просяное зерно. Выделение газа при растворении натрия указывает на присутствие активного водорода. (Однако эту реакцию также могут давать кислоты и СН-кислоты.)
б) Реакция с купрум (II) гидроксидом.
В двух-, трех- и многоатомных спиртах в отличие от одноатомных спиртов растворяется свежеприготовленный купрум (II) гидроксид с образованием темно- синего раствора комплексных солей соответствующих производных (гликолятов, глицератов).
В пробирку наливают несколько капель (0,3 — 0,5мл) 3-процентного раствора купрум (ΙΙ) сульфата, а затем 1 мл 10-процентного раствора натрий гидроксида. Выпадает студенистый голубой осадок купрум (ΙΙ) гидроксида.. Растворение осадка при добавлении 0,1 г исследуемого вещества и изменение цвета раствора до темно-синего подтверждают присутствие многоатомного спирта с гидроксильными группами, расположенными у соседних атомов карбона.
4. Качественные реакции фенолов.
а) Реакция с ферум (III) хлоридом.
Фенолы дают с ферум (III) хлоридом интенсивно окрашенные комплексные соли. Обычно появляется глубокая синяя или фиолетовая окраска. Некоторые фенолы дают зеленое или красное окрашивание, оно ярче проявляется в воде и хлороформе и хуже в спирте.
В пробирку помещают несколько кристаллов (или 1 — 2 капли) исследуемого вещества в 2 мл воды или хлороформа, затем добавляют при встряхивании 1 — 2 капли 3 процентного раствора ферум (III) хлорида. В присутствии фенола появляется интенсивная фиолетовая или синяя окраска. Алифатические фенолы с ферум (ΙΙΙ) хлоридом в спирте дают более яркую окраску, чем в воде, а для фенолов характерно кроваво-красное окрашивание.
б) Реакция с бромной водой.
Фенолы со свободными орто- и пара -положениями в бензольном ядре легко обесцвечивают бромную воду, при этом получается осадок 2,4,6- трибромфенола

Небольшое количество исследуемого вещества встряхивают с 1 мл воды, затем прибавляют по каплям бромную воду. Происходит обесцвечивание раствора и вьпадение белого осадка.
5. Качественные реакции альдегидов.
В отличие от кетонов все альдегиды легко окисляются. На этом свойстве основано открытие альдегидов, но не кетонов.
а) Реакция серебряного зеркала.
Все альдегиды легко восстанавливают аммиачный раствор аргентум (Ι) оксида. Кетоны не дают этой реакции:

В хорошо вымытой пробирке смешивают 1 мл раствора нитрата серебра с 1 мл разбавленного раствора натрий гидроксида. Выпавший осадок аргентум (Ι) гидроксида растворяют при добавлении 25-процентного раствора аммиака. К полученному раствору прибавляют несколько капель спиртового раствора анализируемого вещества. Пробирку помещают на водяную баню и нагревают до 500 — 600 С. Если на стенках пробирки выделяется блестящий налет металлического серебра, то это свидетельствует о наличии альдегидной группы в образце.
Следует отметить, что эту реакцию могут давать также и другие легко окисляющиеся, соединения: многоатомные фенолы, дикетоны, некоторые ароматические амины.
б) Реакция с фелинговой жидкостью.
Альдегиды жирного ряда способны восстанавливать двухвалентный купрум до одновалентного:

Пробирку с 0,05 г вещества и З мл фелинговой жидкости нагревают З -- 5 минут на кипящей водяной бане. Появление желтого или красного осадка купрум (I) оксида подтверждает наличие альдегидной группы.
б. Качественные реакции кислот.
а) Определение кислотности.
Водно-спиртовые растворы карбоновых кислот показывают кислую реакцию на лакмус, конго или универсальный индикатор.
Каплю водно-спиртового раствора исследуемого вещества наносят на синюю влажную бумажку лакмуса, конго или универсального индикатора. При наличии кислоты индикатор меняет свой цвет: лакмус становится розовым, конго-синим, а универсальный индикатор в зависимости от кислотности - от желтого до оранжевого.
Следует иметь в виду, чтосульфокислоты, нитрофенолы инекоторые другие соединения с подвижным «кислым» гидрогеном, не содержащие карбоксильной группы, могут давать также изменение цвета индикатора.
б) Реакция с натрий гидрокарбонатом.
При взаимодействии карбоновых кислот с натрий гидрокарбонатом происходит выделение карбон(IY) оксида:
В пробирку наливают 1 — 1,5 мл насыщенного раствора натрий гидрокарбоната и добавляют 0,1 — 0,2 мл водно-спиртового раствора исследуемого вещества. Выделение пузырьков карбон(IY) оксида указывает на наличие кислоты.
RCOOH + NaHCO3 → RCOONa + CO2 + H2O
7. Качественные реакции аминов.
Амины растворяются в кислотах. Многие амины (особенно алифатического ряда) обладают характерным запахом (селедочный, аммиачный и др.).
Основность аминов. Алифатические амины как сильные основания способны изменять окраску таких индикаторов, как красный лакмус, фенолфталеин, универсальная индикаторная бумага.
Каплю водного раствора исследуемого вещества наносят на индикаторную бумажку (лакмус, фенолфталеин, универсальная индикаторная бумага). Изменение окраски индикатора свидетельствует о присутствии аминов. В зависимости от строения амина основность его меняется в большом диапазоне. Поэтому лучше использовать универсальную индикаторную бумагу.
8. Качественные реакции полифункциональных соединений.
Для качественного обнаружения бифункциональных соединений (углеводы, аминокислоты) используйте комплекс вышеописанных реакций.
2.4.Биоорганические исследования
Задание. Отработать технику и разработать методику демонстрационных опытов, направленных на обнаружение и изучение свойств биоорганических соединений.
Оборудование: пробирки, пробиркодержатели, шпатели, газовые горелки, пипетки, куриное яйцо, водяная баня, предметные стекла, микроскоп, набор для препарирования тканей, семена подсолнечника, подсолнечное масло, животный жир или маргарин, жирное мясо и др. пищевые продукты согласно приведенным методикам.
Реактивы: глицин, нингидрин, купрум (II) сульфат, натрий гидроксид, аммоний сульфат, нитратная кислота, сульфатная кислота, хлоридная кислота, этанол, ацетон, натрий хлорид, плюмбум ацетат, глюкоза, фруктоза, сахароза, лактоза, мальтоза, крахмал,. Гликоген, аргентум (Ι) нитрат, раствор аммиака, резорцин, кобальт (II) сульфат, никел (II) сульфат, йодная вода, судан III., калий гидросульфат, трихлорацетатная кислота, сульфосалициловая кислота.
Для обнаружения биоорганических молекул в биологических объектах и средах используют следующие качественные реакции.
Опыт 1. Обнаружение а -аминокислот.
Универсальной реакцией на α-аминогруппы является нингидриновая реакция.
К 2 мл 1 процентного раствора аминокислоты (глицина) приливают 2 – 3 капли 0,1-процентного раствора нингидрина и слегка подогревают реакционную смесь. Появляется фиолетовая окраска с синеватым оттенком.
Используйте нингидриновую реакцию для обнаружения α- аминокислот в вытяжке из мышечной кашицы.
Опыт 2. Обнаружение белка.
Для открытия белка используют нингидриновую (на α-аминогруппы), биуретовую (на пептидные связи) и ксантопотеиновую реакции (на остатки ароматических аминокислот). Применимы также и реакции осаждения белков:
· Концентрированными растворами нейтральных солей (высаливание аммоний сульфатом);
· Минеральными (нитратная, хлоридная, сульфатная) и органическими кислотами (трихлорацетатная, сульфосалициловая);
· Органическими растворителями (этанол, ацетон) в присутствии электролитов (например, раствора NaСl);
· Солями тяжелых металлов (Аg, РЬ, Cu, Fе, и др.);
· Осаждение при нагревании.
Используйте цветные реакции на белки для их открытия в мясном бульоне, желатине, курином яйце, молоке, сыре, твороге и пр.
Опыт 3. Обнаружение глюкозы.
Глюкозу открывают реакцией с купрум (II) гидроксидом (реакция на многоатомные спирты) и реакцией серебряного зеркала (реакция на альдегидную группу).
Проведите обнаружение глюкозы в виноградном соке.
Опыт 4. Обнаружение фруктозы.
В пробирку наливают 2 мл раствора хлоридной кислоты (1:1), добавляют несколько кристалликов резорцина и 0,5 мл 1-процентного раствора фруктозы. Пробирку помещают на 8 мин в водяную баню с температурой воды 800 С, наблюдают развитие малиново-красного окрашивания.
Используйте реакцию для обнаружения фруктозы в меде.
Опыт 5. Обнаружение сахарозы.
Сахарозу открывают специфическими цветными реакциями с солями никеля (II) и кобальта (II), а также по отрицательной пробе в реакции окисления купрум (II) гидроксидом в щелочной среде.
Используйте цветные реакции для открытия сахарозы в тростниковом(свекловичном) сахаре, овощных соках.
Опыт 6. Обнаружение лактозы и мальтозы.
Лактозу (молочный сахар) и мальтозу (солодовый сахар) обнаруживают реакцией окисления купрум (II) гидроксидом в щелочной среде, а также реакцией серебряного зеркала.
Используйте данные реакции для открытия лактозы в молочной сыворотке и мальтозы в пиве.
Опыт 7. Обнаружение резервных полисахаридов.
Обнаружение резервных полисахаридов ведут реакцией с йодом, при этом крахмал дает интенсивное синее окрашивание, а гликоген — красно-бурое.
Используйте йодную пробу для обнаружения крахмала в пищевых продуктах (картофель, мука, хлеб, банан, спелое и неспелое яблоко, вареная колбаса и пр.), а гликогена — в вытяжке из печеночной ткани.
Опыт 8. Обнаружение липидов.
а) обнаружение жира в животных и растительных тканях. Небольшое количество (на кончике шпателя) красителя судана III растворяют в 30 мл спирта. По 2 -3 капли раствора красителя наносят на предметные стекла с
заранее подготовленными срезами семян подсолнечника и жирного мяса и рассматривают под микроскопом. При соприкосновении тканей с реактивом развивается красное окрашивание.
Опыт можно провести в пробирке с растительным маслом.
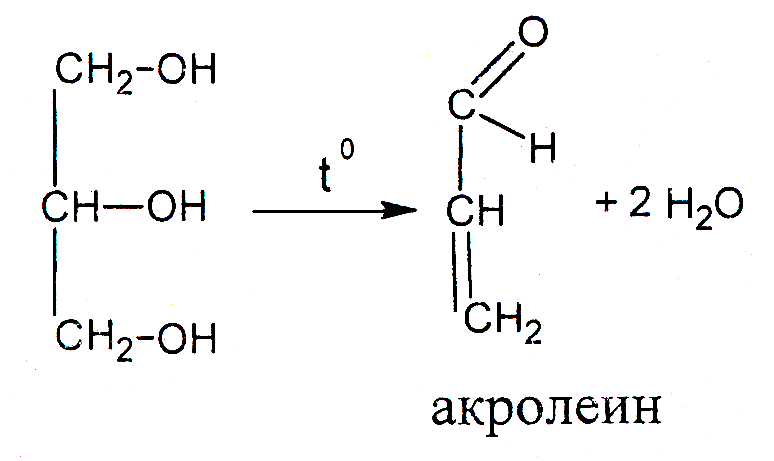
б) акролеиновая проба на глицерин (образование акролеина при термическом разложении жира). В сухую пробирку помещают немного кристаллического калий гидросульфата (обезвоживающее вещество) и 1 каплю подсолнечного масла или растопленного твердого жира (говяжьего, свиного, бараньего). Пробирку нагревают сначала осторожно, затем сильно. Смесь обугливается, из пробирки выделяются пары воды и летучие продукты разложения жира, в том числе имеющий резкий характерный запах акролеин.
При термическом разложении жир подвергается гидролизу. Акролеин образуется при дегидратации глицерина по схеме:
Рекомендуемая литература
Основная
1. Верховский В.Н. Техника и методика химического эксперимента в школе. – М.: Учпедгиз, 1953, - 452с.
2. Величко Л.П. Раздаточний материал по органической химии. – К.: Лыбидь, 1999, – 80с.
3. Грабецкий А.А., Зазнобина Л.С., Назарова Т.С. Использование средств обучения на уроках химии. М.: Просвещение, 1988. – 160с.
4. Максимов О.С. Методика викладання хімії. Практикум. – К.: Вища шк., 2000. – 168с.
5. Черников И.Н., Черняк И.А., Колударов Ю.А. Самодельные динамические приборы по химии. – М.: Просвещение, -1976. –131с.
Дополнительная
1. Беликов А.А. Эксперимент на уроках химии. – К.: Рад. шк., 1988. – 180с.
2. Гладюк М.М. Дидактичні матеріали з хімії. 8 клас. – Т.: Підручники та посібники, 2000. – 80с.
3. Злотников Э.Г. Проведение экспериментального практикума по химии // Химия в шк. – 1990. - №1. – С. 46 – 49.
4. Найдан В.М., Грабовий А.К. Використання засобів навчання на уроках хімії. – К.: Рад. шк., 1988. – 218с.
5. Полосин В.С. Кляхина З.П., Ширина Л.К. Самодельные динамические пособия по химии. – М.: Просвещение, 1973. – 128с.
6. Полосин В.С., Прокопенко В.Г. Практикум по методике преподавания химии. – М.: Просвещение, 1989. – 224с.
Приложение 1.
Тематика наглядных пособий
1. Образование молекул простых и сложных веществ (схема или динамическая модель).
2. Распределение химических элементов в природе (таблица или диаграмма).
3. Объёмный состав воздуха (диаграмма).
4. Строение атома (динамическая модель).
5. Образование ковалентной связи (динамическая модель).
6. Типы кристаллических решеток (модели).
7. Применение сульфатной кислоты (диаграмма).
8. Применение хлора (схеме).
9. Процесс диссоциации электролитов в растворе (плоскостная динамическая модель).
10. Изменение свойств гидроксидов в зависимости от размера радиуса и заряда центрального атома элемента (модель).
11. Связь применения алюминия с его свойствами (схема).
12. Моделирование химико-технологических процессов (конвертор Бессемера с продувкой кислорода сверху; промышленная установка гидратации этилена; установка для горячего прессования изделий из пластмасс и др.).
13. Распознавание пластмасс (схема или таблица).
14. Распознавание удобрений (схема или таблица).
15. Коллекции (минеральные удобрения; металлы и сплавы; горные породы и минералы Донецкого региона; красители; виды топлива; товары бытовой химии; полимеры и пластмассы; волокна и ткани и др.).
16. Строение вулканизированного каучука (модель).
17. Структура белка (объёмная модель).
18. Объёмные и шаростержневые модели органических веществ:
- углеводороды (метан, конформация этана, этилен, цис(транс)-изомерия
алкенов, бутадиен, ацетилен, бензен, природа ароматичности, циклопропан);
- оксигенсодержащие органические вещества (метанол, формальдегид, строение карбоксильной группы, водородные связи в молекулах спиртов, фенолов и карбоновых кислот; гибкая модель, характеризующая открыто-цепную таутомерию глюкозы);
- нитрогенсодержащие органические вещества (модель, показывающая общность строения аммиака и алифатических аминов; модель, показывающая образование биполярного иона из нейтральных молекул аминокислоты);
19. Ориентация молекул мыла на загрязненной поверхности (объёмная схема).
Сопроводительная карточка наглядного пособия
1. Название наглядного пособия.
2. Группа наглядных пособий.
3. Характер пособия.
4. Раздел, тема программы школьного курса химии или факультатива, где предполагается использование пособия.
5. Целевая установка использования наглядного пособия.
6. Краткое описание пособия.
7. Материал изготовления пособия.
Приложение 2
Схема анализа ситуативной модели урока с использованием химического эксперимента:
1.Тема урока, раздел программы.
2.Цели эксперимента: учебная, воспитательная, развивающая.
3.Вид эксперимента.
4.Место эксперимента на уроке.
5.Техника химического эксперимента.
6.Методика химического эксперимента: формы сочетания слова учителя с химическим экспериментом.
7.Используемые методы обучения и контроля.
8.Сочетание демонстрации химического эксперимента с использованием средств наглядности.
9.Вывод: насколько эксперимент, отобранные методы и средства соответствовали содержанию урока; были ли достигнуты поставленные цели; поведение студента в роли учителя, его речь и правильность использования терминологии и номенклатуры.