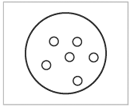
К концу XIX в. были накоплены сведения, подтверждающие сложное строение атома. В тот период был выдвинут целый ряд моделей строения атома. Одна из первых моделей была предложена Джозефом Томсоном в 1903 г. Томсоновская модель «сливового пудинга» (в русском литературном переводе – «булочка с изюмом») уподобляла атом положительно заряженному сферическому пудингу, в который вкраплены отрицательно заряженные шарики – электроны (рис. 1.1).
|
| Рис. 1.1. Модель атома в виде «булочки с изюмом» (Дж.Томсон, 1903 г.)
|
В жизни часто случается, что ученики продолжают путь, начатый учителями, и идут в этом направлении дальше. Так, ученик Томсона Эрнест Резерфорд на основе данных подготовленного и проведенного им эксперимента сделал вывод, что в атоме положительный заряд сконцентрирован в малом объеме.
Ханс Гейгер и Эрнест Марсден были студентами Резерфорда. В 1910 г. они проводили эксперименты, в которых бомбардировали тонкие листы золотой фольги пучком  -частиц (ядер атомов гелия) (рис. 1.2). Толщина золотой фольги варьировалась от 1000 до 10 000 атомов. В ходе эксперимента было обнаружено, что подавляющее большинство
-частиц (ядер атомов гелия) (рис. 1.2). Толщина золотой фольги варьировалась от 1000 до 10 000 атомов. В ходе эксперимента было обнаружено, что подавляющее большинство  -частиц совершенно свободно проходило через фольгу, причем некоторые из них лишь незначительно отклонялись от первоначального направления. Однако примерно одна из 10 000–100 000 частиц резко изменяла свое направление на противоположное.
-частиц совершенно свободно проходило через фольгу, причем некоторые из них лишь незначительно отклонялись от первоначального направления. Однако примерно одна из 10 000–100 000 частиц резко изменяла свое направление на противоположное.

|
| Рис. 1.2. Эксперимент Х.Гейгера и Э.Марсдена
|
Это наблюдение заставило Резерфорда выдвинуть новую модель атома, согласно которой положительно заряженное ядро окружено электронами (рис. 1.3).

|
| Рис. 1.3. Модель атома с положительно заряженным ядром и вращающимися вокруг него электронами (Э.Резерфорд, 1911 г.)
|
Рассчитанный на основе данных проведенного эксперимента размер ядра атома оказался примерно в 100 000 раз меньше размера самого атома. К примеру, если бы диаметр ядра составлял 1 см, то диаметр атома был бы 1 км. И в этой малой части пространства, занимаемого ядром, сосредоточено более 99,9% массы атома.
После этого Резерфорд предсказал существование протона и показал, что его масса более чем в 1800 раз должна превышать массу электрона. Существование нейтрона было предсказано Резерфордом в 1920 г. Экспериментально нейтрон был обнаружен в 1932 г.
Началом современной теории электронного строения атомов послужила его планетарная квантовая модель, которую в 1913 г. выдвинул Нильс Бор. Обоснованием этой и более поздних моделей атома служат главным образом три источника данных: атомные спектры, энергии ионизации атомов, сродство атомов к электрону.
Алканы
Алка́ны (насыщенные углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными соединениями и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp³ гибридизации. Простейшим представителем класса является метан (CH4)


 -частиц (ядер атомов гелия) (рис. 1.2). Толщина золотой фольги варьировалась от 1000 до 10 000 атомов. В ходе эксперимента было обнаружено, что подавляющее большинство
-частиц (ядер атомов гелия) (рис. 1.2). Толщина золотой фольги варьировалась от 1000 до 10 000 атомов. В ходе эксперимента было обнаружено, что подавляющее большинство 




