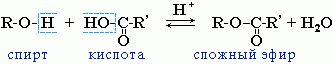IV. Реакции этерификации
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
3. Гидролиз солей – это реакция обмена ионов соли с водой, в результате которой изменяется кислотность раствора. Гидролиз – процесс обратный реакции нейтрализации. Если реакция нейтрализации процесс экзотермический и необратимый, то гидролиз – процесс эндотермический и обратимый. Реакция нейтрализации 2KOH + H2SO3 = K2SO3 + 2H2O 2OH- + H2SO3 = 2H2O + SO32 сильный слабый сильный слабый Реакция гидролиза K2SO3+ H2O = KOH + KHSO3 SO32- + HOH = HSO3- + OH- При гидролизе смещается равновесие диссоциации воды вследствие связывания одного из ее ионов (Н+ или ОН-) в слабый электролит соли. При связывании ионов Н+ в растворе накапливаются ионы ОН−, реакция среды будет щелочная, а при связывании ионов ОН− накапливаются ионы Н+ - среда будет кислая. Разберем случаи гидролиза, пользуясь понятиями "слабый" и "сильный" электролит. Соль образована сильным основанием и слабой кислотой (гидролиз протекает по аниону). Это имеет место при гидролизе соли СН3СООК. Ионы соли СН3СОО− и К+ взаимодействуют с ионами Н+ и ОН− из воды. При этом ацетат-ионы (СНзСОО−) связываются с ионами водорода (Н+) в молекулы слабого электролита - уксусной кислоты (CHзCOOH), а ионы ОН− накапливаются в растворе, сообщая ему щелочную реакцию, так как ионы К+ не могут связать ионы ОН−(КОН является сильным электролитом), pH >7. СН3СОО К + H2O ↔;КОН + СН3ООН молекулярное уравнение К+ + СН3СОО− + НОН ↔; K+ + ОН− + СН3СООН полное ионное уравнение СН3СОО− + Н ОН ↔; ОН− + СН3СООН сокращенное ионное уравнение Гидролиз соли Na2 S протекает ступенчато. Соль образована сильным основанием и слабой двухосновной кислотой. В этом случае анион соли S2− связывает ионы Н+ воды, в растворе накапливаются ионы ОН−. Уравнение в ионной и молекулярной форме по первой ступени имеет вид 1-я ступень S2− + НОН ↔;HS− + ОН− сокращенное уравнение Na2S + Н2О ↔; NaHS + NaOH молекулярное уравнение Вторая ступень гидролиза практически не проходит при обычных условиях, так как, накапливаясь, ионы ОН− сообщают раствору с и л ь н о щ е л о ч н у ю реакцию, что приводит к реакции нейтрализации, сдвигу равновесия влево. 2-я ступень HS− + НОН ↔;H2S + ОН− сокращенное уравнение NaHS + Н2О ↔;NaOH + H2S молекулярное уравнение Соль образована слабым основанием и сильной кислотой (гидролиз протекает по катиону). Это имеет место при гидролизе соли NH4Cl (NH4ОH - слабое основание, НСl - сильная кислота). Отбросим ион Сl−, так как он с катионом воды дает сильный электролит, тогда уравнение гидролиза примет следующий вид: NH4+ + НОН ↔ NH4OH + Н+ сокращенное уравнение NH4Cl + Н2О ↔ NH4OH + НСl молекулярное уравнение Из сокращенного уравнения видно, что ионы ОН− воды связываются в слабый электролит, ионы Н+ накапливаются в растворе и cреда становится кислой pH <7. Гидролиз соли Zn(NO3)2 протекает ступенчато по катиону слабого основания. 1-я ступень Zn2+ + НОН ↔ ZnOH+ + H+ сокращенное уравнение Zn(NO3)2 + Н2О ↔ ZnOHNO3 + HNO3 молекулярное уравнение ионы ОН− связываются в слабое основание, ионы Н+ накапливаются. Вторая ступень гидролиза практически не происходит при обычных условиях, так как в результате накопления ионов H+ в растворе создается с и л ь н о к и с л а я среда и гидроксид цинка растворяется. 2-я ступень ZnOH+ + НОН ↔ Zn(OH)2 + H+ сокращенное уравнение ZnOHNO3 + Н2О ↔ Zn(OH)2 + HNO3 молекулярное уравнение Соль образована слабым основанием и слабой кислотой (гидролиз протекает по катиону и аниону). Это имеет место при гидролизе соли СН3СООNH4. Запишем уравнение в ионной форме, pH ≈ 7: NH4+ + CH3COO− + НОН ↔ NH4OH + СН3СООН Образуются слабое основание и слабая кислота, степень диссоциации которых примерно одинакова, поэтому при протекании гидролиза среда раствора будет нейтральная. Билет № 5 1. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; выделению или поглощению энергии; изменению степени окисления химических элементов. Примеры реакций различных типов. ♦ По числу и составу исходных и полученных веществ химические реакции бывают: 1. Соединения — из двух или нескольких веществ образуется одно сложное вещество: 2. Разложения — из одного сложного вещества образуется два или несколько веществ: 3. Замещения — атомы простого вещества замещают один из элементов в сложном веществе: 4. Обмена — 2 сложных вещества обмениваются составными частями: ♦ Реакции, протекающие с выделением энергии (тепла), называются экзотермическими. К ним относятся реакции горения, например серы: S + O2 = SO2 + Q Реакции, требующие затрат энергии, т.е. протекающие с поглощением энергии, называются эндотермическими. Эндотермической является реакция разложения воды под действием электрического тока: 2H2O = 2H2 + O2 − Q ♦ Реакции, сопровождающиеся изменением степеней окисления элементов, т.е. переходом электронов, называются окислительно-восстановительными: Fe0 + S0 = Fe+2S−2 Противоположностью являются электронно-статичные реакции, часто их называют просто реакции, протекающие без изменения степени окисления. К ним относятся все реакции обмена: H+1Cl−1 + Na+1O−2H+1 = Na+1Cl−1 + H2+1O−2 (Напомним, что степень окисления в веществах, состоящих из двух элементов, численно равна валентности, знак ставится перед цифрой) 2. Опыт. Проведение реакций, подтверждающих качественный состав предложенной соли, например сульфата меди(II). Качественный состав соли доказывают с помощью реакций, сопровождающихся выпадением осадка или выделением газа с характерным запахом или цветом. Образование осадка происходит в случае получения нерастворимых веществ (определяем по таблице растворимости). Газы выделяются при образовании слабых кислот (для многих требуется нагревание) или гидроксида аммония. Наличие иона меди можно доказать добавлением гидроксида натрия, выпадает синий осадок гидроксида меди (II): CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 Дополнительно можно провести разложение гидроксида меди (II) при нагревании, образуется черный оксид меди (II): Cu(OH)2 = CuO + H2O Наличие сульфат-иона доказывается выпадением белого кристаллического осадка, нерастворимого в концентрированной азотной кислоте, при добавлении растворимой соли бария: CuSO4 + BaCl2 = BaSO4↓ + CuCl2
|