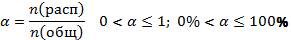Химические свойства белков
Свойства белков объясняет их различное строение. Большинство белков аморфно, в спирте, эфире и хлороформе нерастворимо. В воде некоторые белки могут растворяться с образованием коллоидного раствора. Многие белки растворимы в растворах щелочей, некоторые - в растворах солей, а некоторые - в разбавленном спирте. Кристаллическое состояние белов встречается редко: примером могут быть алейроновые зёрна, встречающиеся в клещевине, тыкве, конопле. Кристаллизуется также альбумин куриного яйца и гемоглобин в крови. Применение и получение белков применении и проблеме синтеза белков. Шерсть, кожу и натуральный шелк применяют для изготовления одежды. Задачу синтеза белка в лаборатории решают тремя способами: 1. Производством кормовых дрожжей. 2. Приготовлением белково-витаминных концентратов на базе углеводородов нефти. 3. Выделением белков из непищевого сырья растительного происхождения. В нашей стране из углеводородного сырья изготавливают белково-витаминный концентрат. В качестве заменителя белка перспективно также промышленное производство незаменимых аминокислот. 3. Типовые задачи на количество вещества, молярную массу и молярный объём Основные формулы. Количество вещества n=m/M, где m-масса вещества, М-молярная масса. Число молекул N =NA·n, где N-число молекул, NA-число Авогадро (6,02·1023моль-1); V= V M·n, где V M =22,4 л/моль Сколько молей составляют и сколько молекул содержат 180 мл воды H2O? Найти: n(H2O); N(H2O) Решение: Ответ: 180 мл воды составляют 10 моль и содержат 6,02·1024 молекул
Билет № 6 1. Основные положения теории электролитической диссоциации 1. Электролиты в растворах под действием растворителя самопроизвольно распадаются на ионы. Такой процесс называется электролитической диссоциацией. Диссоциация также может проходить при расплавлении твердых электролитов. 2. Ионы отличаются от атомов по составу и свойствам. В водных растворах ионы находятся в гидратированном состоянии. Ионы в гидратированном состоянии отличаются по свойствам от ионов в газообразном состоянии вещества. Это объясняется так: в ионных соединениях уже изначально присутствуют катионы и анионы. При растворении молекула воды начинает подходить к заряженным ионам: положительным полюсом – к отрицательному иону, отрицательным полюсом – к положительному. Ионы называются гидратированными (рис. 2).
Рис. 2 3. В растворах или расплавах электролитов ионы движутся хаотично, но при пропускании электрического тока ионы движутся направленно: катионы – к катоду, анионы – к аноду. Основания, кислоты, соли в свете теории электролитической диссоциации В свете теории электролитической диссоциации можно дать определении основаниям, кислотам и солям как электролитам. Основания – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид анионов: гидроксид-анион: OH-. NaOH ↔ Na+ + OH− Диссоциация оснований, содержащих несколько гидроксильных групп, происходит ступенчато: Ba(OH)2↔ Ba(ОН)+ + OH− Первая ступень Ba(OH)+ ↔ Ba2+ + 2OH− Вторая ступень Ba(OH)2↔ Ba2+ + 2 OH− Суммарное уравнение Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов: H+. Ионом водорода называют именно гидратированный протон и обозначают H3O+, но для простоты записывают H+. HNO3↔ H+ + NO3− Многоосновные кислоты диссоциируют ступенчато: H3PO4↔ H+ + H2PO4- Первая ступень H2PO4- ↔ H+ + HPO42- Вторая ступень HPO42-↔ H+ + PO43- Третья ступень H3PO4↔ 3H+ + PO43-Суммарное уравнение Соли – это электролиты, диссоцирующие в водных растворах на катионы металла и анионы кислотного остатка. Средние соли – это электролиты, диссоциирующие в водных растворах на катионы металла или катионы аммония и анионы кислотного остатка. Основные соли – это электролиты, диссоциирующие в водных растворах на катионы металла, гидроксид анионы и анионы кислотного остатка. Кислые соли – это электролиты, диссоциирующие в водных растворах на катионы металла, катионы водорода и анионы кислотного остатка. Двойные соли – это электролиты, диссоциирующие в водных растворах на катионы нескольких металлов и анионы кислотного остатка. KAl(SO4)2↔ K+ + Al3+ + 2SO42 Смешанные соли – это электролиты, диссоциирующие в водных растворах на катионы металла и анионы нескольких кислотных остатков Сильные и слабые электролиты Электролитическая диссоциация в той или иной степени – процесс обратимый. Но при растворении некоторых соединений равновесие диссоциации в значительной степени смещено в сторону диссоциируемой формы. В растворах таких электролитов диссоциация протекает практически необратимо. Поэтому при написании уравнений диссоциации таких веществ пишется или знак равенства или прямая стрелка, обозначающая, что реакция происходит практически необратимо. Такие вещества называют сильными электролитами. Слабыми называются электролиты, в которых диссоциация происходит незначительно. При написании используют знак обратимости. Табл. 1. Для количественной оценки силы электролита введено понятие степени электролитической диссоциации.
Силу электролита можно охарактеризовать и при помощи константы химического равновесия диссоциации. Называется она константа диссоциации. Факторы, влияющие на степень электролитической диссоциации: · Природа электролита · Концентрация электролита в растворе · Температура При увеличении температуры и разбавлении раствора степень электролитической диссоциации увеличивается. Поэтому оценить силу электролита можно, только сравнивания их при одинаковых условиях. За стандарт принята t = 180С и с = 0,1 моль/л.
|