Водород и его соединения
Французский химик А. Лавуазье установил, что «горючий воздух», выделяющийся при взаимодействии кислот и металлов, входит в состав воды и может быть из нее получен. В 1787 Лавуазье пришел к выводу, что «горючий воздух» представляет собой простое вещество, и, следовательно, относится к числу химических элементов. Он дал ему название hydrogene (от греческого hydor — вода и gennao — рождаю) — «рождающий воду».
Изотопный состав: В ПСЭ водород занимает протяженную клетку над элементами II периода (исключая неон), т.к. имеет сходство, как со щелочными металлами, так и с галогенами. Водород в силу своего строения проявляет окислительно-восстановительную двойственность: Н2 + галогены водородогалогены, (Н2 – восстановитель (Н Н2 + шелочные, щелочноземельные металлы гидриды (NaH, CaH2), (Н2 – окислитель (Н Молекула водорода представляет собой пример простейшей молекулы, состоящей их двух атомов, связанных ковалентной связью. Вследствие большой прочности и высокой энергии диссоциации, равной В организме содержание водорода составляет 9,7%. Водород связан полярной ковалентной связью с другими биогенными элементами или присутствует в виде свободного Н+. С точки зрения химической термодинамики водород в живых системах, содержащих воду, не может образовывать молекулярный водород или гидрид-ионы. Молекулярный водород при обычных условиях летуч и малоактивен, поэтому в обмене веществ не участвует. Гидрид-ион, наоборот, чрезвычайно активен, немедленно реагирует с водой, образуя молекулярный водород. Среди всех органогенов у водорода наименьшая относительная электроотрицательность (ОЭО = 2,1), поэтому в природных соединениях он всегда проявляет степень окисления +1. Окислительная способность катионов водорода в живых системах в нейтральной среде сильно понижена (j°= –0,42В), поэтому в организме он не проявляет окислительных свойств, но участвует во многих окислительно-
пируват лактат
НАД+ + 2 е + 2Н+ ¾® НАД(Н) + Н+ (НАД, НАДФ – коферменты дегидрогеназ)
В организме водород входит в состав углеводов, белков, нуклеиновых кислот и др., образуя химические связи с углеродом, азотом, кислородом и серой. По степени полярности ковалентные связи водорода с атомами элементов-органогенов располагаются в следующий ряд:
Увеличение полярности связи
Кислотные свойства природных соединений определяются полярностью этих связей и их поляризуемостью. Так, с учетом высокой поляризуемости связи S–H, способность к диссоциации наибольшая у S–H, наименьшая у С–Н. Связи с углеродом и серой мало полярны, обусловливают образование гидрофобных участков в молекулах белков и липидов. Окисление связей С–Н является главным источником энергии живых организмов. Связи водорода с кислородом и азотом сильно полярны и наиболее активны. Водород в виде протона быстро переходит от одних ионов и молекул к другим, образует водородные связи. Благодаря особенностям своего строения водород образует водородные связи, как в воде, так и в растворенных в ней веществах – сахарах, белках, нуклеиновых кислотах и т.п. Водородные связи между комплементарными парами азотистых оснований обеспечивают вторичную структуру ДНК и репликацию матричных РНК. Концентрация ионов водорода (рН = –lg a (H+)) в водной среде определяет ее кислотность и оказывает влияние на состояние белков, в частности, ферментов. рН крови величина постоянная, равная 7,36–7,42, является важным диагностическим тестом. Большинство биологических жидкостей организма имеют рН в пределах 5,0–7,5, только желудочный сок имеет очень кислую среду, (рН = 0,9–1,5). Содержащиеся в желудочном соке катионы гидроксония Н3О+ проявляют противомикробное действие, убивая занесенные в желудок с пищей микроорганизмы, а также катализируют переход неактивного пепсиногена в активный фермент пепсин. В кислой среде желудочного сока большинство белков денатурируются, что облегчает их гидролиз пепсином. Основное количество атомов водорода заключено в воде, на долю которой приходится» 90% массы живой клетки. Все химические процессы в организме проходят в водной среде. Организм человека весом 70 кг, содержит» 45 л воды.
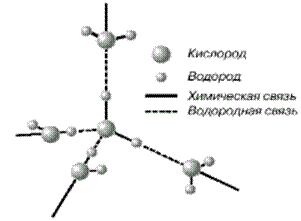
…Водород растворяется в воде очень слабо — около 0,02 объёма на объём воды, зато в одном объёме палладия растворяется до 850 объёмов водорода! …При сгорании водорода в чистом кислороде развивается температура до 2800°C – такое пламя легко плавит кварц и большинство металлов. Но с помощью водорода можно достичь и более высокой температуры, если использовать его не как источник, а как переносчик и концентратор энергии. …Водород как элемент доминирует во Вселенной. На его долю приходится около половины массы Солнца и других звезд, он присутствует в атмосфере ряда планет. Вода Вода – важнейшее соединение водорода. Вода – вещество без вкуса, цвета и запаха. При атмосферном давлении 101,3 кПа температура кипения её равна 373,15 К, а температура замерзания – 273,15 К. За счет двух неподеленных электронных пар на атоме кислорода и за счет двух атомов водорода молекула воды может образовывать водородные связи с четырьмя окружающими её молекулами воды (рис.3).
Строение молекулы воды угловое, она представляет собой диполь с валентным углом 104,3о.
Рис. 3. Схема объединения молекул воды
Потребность в воде взрослого человека составляет 35 г в день на 1 кг массы тела, а грудного ребенка – в 3-4 раза больше. Гибель организма наступает при потере 20% воды. Функции воды: · Универсальный растворитель органических и неорганических веществ · Среда, в которой протекают реакции, осуществляется транспорт и обмен веществ · Активный участник процессов жизнедеятельности · Определяет физико-химическое состояние коллоидных систем · Участвует в процессах терморегуляции Благодаря своим уникальным свойствам вода является средой, растворителем и метаболитом (табл. 2). В настоящее время установлено, что при растворении любых веществ изменяются структурно-информационные свойства самой воды, что существенным образом влияет на биологические и физиологические функции биосубстратов. Таблица 2
|

 Водород – s -элемент, в природных соединениях проявляет степень окисления +1, с элементами-органогенами образует только ковалентные связи. Ион Н+– это протон, размеры которого в 104 раз меньше размера атома, поэтому положительно поляризованный атом водорода обладает сильным поляризующим действием. Н+– активный комплексообразователь, носитель кислотных свойств, атомы Н сильнополярных связей О-Н, N-Н образуют водородные связи.
Водород – s -элемент, в природных соединениях проявляет степень окисления +1, с элементами-органогенами образует только ковалентные связи. Ион Н+– это протон, размеры которого в 104 раз меньше размера атома, поэтому положительно поляризованный атом водорода обладает сильным поляризующим действием. Н+– активный комплексообразователь, носитель кислотных свойств, атомы Н сильнополярных связей О-Н, N-Н образуют водородные связи.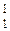 Н – протий (99,985%),
Н – протий (99,985%), 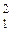 Н – дейтерий (0,015%),
Н – дейтерий (0,015%), 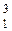 Н – тритий (радиоактивен).
Н – тритий (радиоактивен).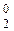 -2 е = 2Н+1).
-2 е = 2Н+1). восстановительных процессах, не меняя свою степень окисления, например:
восстановительных процессах, не меняя свою степень окисления, например: Н–С < Н–S < H–N < H–O
Н–С < Н–S < H–N < H–O
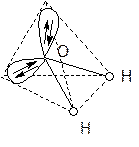
 Тип гибридизации атомных орбиталей кислорода в молекуле Н2О – sp 3, причем две орбитали заняты неподеленными электронными парами.
Тип гибридизации атомных орбиталей кислорода в молекуле Н2О – sp 3, причем две орбитали заняты неподеленными электронными парами.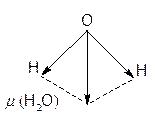
 Содержание воды в организме от массы человека: эмбрион (97%), новорожденный (77%), взрослые (18-55 лет) – у женщин в среднем 54%, у мужчин – 61%.
Содержание воды в организме от массы человека: эмбрион (97%), новорожденный (77%), взрослые (18-55 лет) – у женщин в среднем 54%, у мужчин – 61%.



