Краткая химическая характеристика р-элементов
Химические элементы, в атомах которых последним заполняется электронами внешний р -подуровень (ns2np1– ns2np6), назваются Согласно классификации В.И. Вернадского р -элементы по их содержанию в организме можно разделить следующим образом: а) органогены: О, С, N, P, S; б) микроэлементы: F, I, Br, Si, B, Al; в) ультрамикроэлементы: Ga, Ge, As, Bi, Se, Sn. Пятнадцать р -элементов – типичные неметаллы. Они занимают в ПСЭ верхний правый угол, образуя треугольник, вершиной которого является фтор, а основанием – линия проходящая через элементы бор-астат. Десять элементов являются типичными металлами и близкими по свойствам к ним: III гр. – Al, Gа, In, Tl IV гр. – Ge, Sn, Pb V гр. – Sb, Bi VI гр. – Ро Оксиды и гидроксиды р -элементов Al, Ga, In, Ge, Pb, As, Sb, Sn обладают амфотерными свойствами. В группах с ростом порядкового номера элемента, по мере появления новых энергетических уровней, происходит возрастание радиусов атомов, уменьшение электроотрицательности и энергии ионизации, связь электрона с ядром уменьшается, легко происходит отрыв электрона и атом превращается в катион, происходит усиление металлических свойств. В периодах слева направо по мере увеличения заряда ядра происходит уменьшение радиусов атомов, возрастание энергии ионизации и электроотрицательности. Ослабляются металлические и усиливаются неметаллические свойства простых веществ р -элементов. При образовании химических связей для р -элементов характерны следующие типы гибридизации: Элементы II периода sp, sp2, sp3 Элементы III периода sp3, sp3d, sp3d2 Элементы IV периода sp3, sp3d, sp3d2 Элементы V, VI периода sp3d2 р -элементы образуют различные бинарные соединения – хлориды, фториды, оксиды, сульфиды, нитриды, фосфиды и др. Свойства бинарных соединений изменяются по периоду ПСЭ, например:
Li2O, BeO, B2O3, CO2, N2O5
увеличение кислотных свойств
Устойчивость бинарных соединений р -элементов зависит от степени окисления как электроположительного, так и электротрицательного элемента: +1 –1 +2 –1 +3 –1 +4 –1 +5 –1 +6 –1 NaCl MgCl2 AlCl3 SiCl4 PCl5 SCl6
SCl4 Cl2
SF6 более устойчив, чем SCl6. Водные растворы водородных соединений р -элементов проявляют кислотные свойства:
SiH4 PH3 H2S HCl; HF HCl HBr HI
Водородные соединения р -элементов обладают восстановительными свойствами:
уменьшение устойчивости увеличение восстановительных свойств
Среди р -элементов комплексообразователями являются Al+3, Pb+2, Bi+3, Tl+, а лигандами О2–, СО Биополимеры содержат функциональные группы с электронодонорными атомами О, N, S и образуют комплексные соединения с ионами металлов, находящимися в организме. Согласно теории Льюиса кислотами являются акцепторы электронов, а основаниями – доноры электронов. Атомы элементов 2-го и 3-го периодов в положительных степенях окисления являются «жёсткими» кислотами, так как, имея восьми электронные оболочки, труднее поляризуются. Положительно заряженные атомы элементов 4–6-го периодов имеют восемьнадцатиэлектронные подоболочки, поэтому поляризуются легче, то есть являются более «мягкими» кислотами. При этом положительно заряженные атомы элементов 4-го периода занимают промежуточное положение. Отрицательно заряженные ионы элементов 2-го (F–, О2–, N–3) и 3-го периодов (Cl–) – «жёсткие» основания, S2–, I– – «мягкие» основания (МО). Согласно теории Пирсона прочные соединения образуются между «жёсткими» кислотами и «жёсткими» основаниями, «мягкими» кислотами (МК) и «мягкими» основаниями (ЖМКО-теория). С помощью этой теории можно объяснить устойчивость, раствори F–, Cl–, Br–, I–, S2–, CN–
В группах сверху вниз «мягкость» кислот возрастает, поэтому увеличивается прочность связи с мягкими основаниями, например, S2–. Ионы Hg+2 и Ag+ образуют очень прочные сульфиды: Ks (HgS) = 4,0×10–53, Ks (Аg2S) = 6,3×10–50. В организме «мягкие» положительно заряженные атомы элементов 5-го и 6-го периодов связываются с биомолекулами через атом серы, блокируя при этом сульфгидрильные (–SH) группы ферментов, чем и обусловлена их высокая токсичность. В ряду галогенид-анионов сверху вниз уменьшается «жёсткость» оснований, поэтому увеличивается прочность связи в комплексных соединениях и малорастворимых электролитах с «мягкими» кислотами, например:
При этом AgI в отличие от AgCl и АgBr не будет растворяться в аммиаке, который является «жёстким» основанием (K н[Ag(NH3)2]+ = 5,9×10–8), а в то же время, будет растворяться в тиосульфате, связываясь с ним через «мягкий» донорный атом серы. AgI + 2S2O Склонностью к комплексообразованию объясняется также токсичность цианидов, так как очень «мягкое» основание CN– активно взаимодействуют с катионами d -металлов в комплексах, замещая в них субстраты.
|


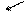

 устойчивость уменьшается
устойчивость уменьшается возрастание силы кислот
возрастание силы кислот NH3 PH3 AsH3 SbH3 BiH3
NH3 PH3 AsH3 SbH3 BiH3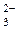 , CN–, SO
, CN–, SO  , S2O
, S2O 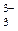 , S2–, OH–, анионы галогенов.
, S2–, OH–, анионы галогенов.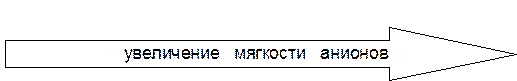 мость и комплексообразующую способность элементов, например:
мость и комплексообразующую способность элементов, например:
 K н
K н
 K н
K н
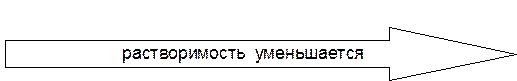 K н
K н



