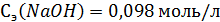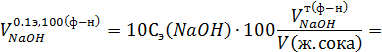Ситуационные и учебно-познавательные задачи.
1. На титрование 15 мл раствора карбоната натрия пошло 13,4 мл 0,15М раствора серной кислоты. Вычислить процентную концентрацию карбоната натрия, если его плотность равна 1,15 г/мл. С каким индикатором надо титровать? Краткое изложение задачи: V(Na2CO3) = 15 мл V(H2SO4) = 13,4 мл
𝜌 индикатор−?
Решение:
Индикатор выбираем с условием рНэ=рТ±1. Поэтому обращаем внимание на продукты реакции: Na2CO3 + H2SO4 ⇄ Соль Na2SO4 не подвергается гидролизу, и кислотность среды в точке эквивалентности обусловлена только угольной кислотой:
= Найденное значение рНэ3,8 попадает в зону перехода цвета индикатора метилового оранжевого (см.табл.1). Ответ: 2. На титрование 10 мл раствора аммиака затрачено 5 мл 0,1э раствора соляной кислоты (хлороводорода). Константа ионизации аммиака Кb 1,77∙ Краткое изложение задачи:
V(HCl) = 5 мл Сэ(HCl) = 0,1 моль/л Кb( Сэ(NH3∙H2O)−? Индикатор−? Выбор индикатора – по условию рНэ=рТ±1. Ориентируемся на продукты реакции (3), которую можно написать в упрощенной форме (без учета молекулы воды в левой и правой части): NH3 + HCl → NH4Cl (6) Отсюда видно, что значение рНэ будет определяться гидролизом соли по катиону:
Таким, образом, найденное значение рНэ 5,2 попадает в зону перехода цвета индикатора метилового красного или бромкрезолового зеленого (см.табл.1). Ответ: 3. Как можно определить концентрацию водного раствора аммиака методом нейтрализации, используя обратное титрование? Решение: К раствору аммиака добавляют избыток титрованного раствора HCl, который затем оттитровывают титрованным раствором NaOH в присутствии фенолфталеина (индикатор на лишнюю каплю щелочи) или другого индикатора, который имеет зону перехода цвета вблизи нейтральной области рН (где будет находиться точка эквивалентности 2-й реакции). Расчет концентрации аммиака. Приведенная ниже схема техники выполнения обратного титрования поможет разобраться в расчетах.
V(NH3∙HOH)
V∑(HCl),
V(NaOH),
По закону эквивалентов:
где 4. Для установки точной концентрации титранта раствора NaOH использовали кристаллическую щавелевую кислоту (H2C2O4∙2H2O). На титрование навески щавелевой кислоты массой 0,063 г пошло 2,5 мл раствора NaOH. Вычислить эквивалентную концентрацию титранта и его титр. Краткое изложение задачи: Решение:
V(NaOH)=2,5 мл
T(NaOH) −?
Ответ: T(NaOH)=
5. Рассчитать содержание соляной кислоты и общую кислотность желудочного сока, если на титрование его 10 мл с метиловым желтым израсходовано 3,1 мл 0,098 э раствора NaOH, а с фенолфталеином – 6 мл такого же раствора NaOH. Краткое изложение задачи: Решение:
Общая кислотность –? V(ж.сока)=10 мл
Поэтому, с учетом поправки на необходимую концентрацию NaOH (0,1э) и объем желудочного сока (100 мл) мы получим: Свободная кислотность (в титр. ед.), обусловленная содержанием соляной кислоты, равна
Общая кислотность (в титр. ед), обусловленная содержанием как соляной кислотой, так и различными видами слабых кислот, равна
Ответ: Содержание соляной кислоты (свободная кислотность) в желудочном соке равно 30,4 т.е.. Общая кислотность желудочного сока равна 58,8 т.е.
|


 −?
−?


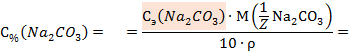



 Н2CO3 + Na2SO4 рНэ<7
Н2CO3 + Na2SO4 рНэ<7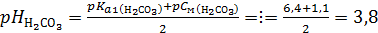
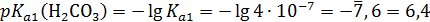



 ; индикатор – метиловый оранжевый.
; индикатор – метиловый оранжевый. . Вычислить эквивалентную концентрацию раствора аммиака. Выяснить, с каким индикатором проводилось титрование.
. Вычислить эквивалентную концентрацию раствора аммиака. Выяснить, с каким индикатором проводилось титрование.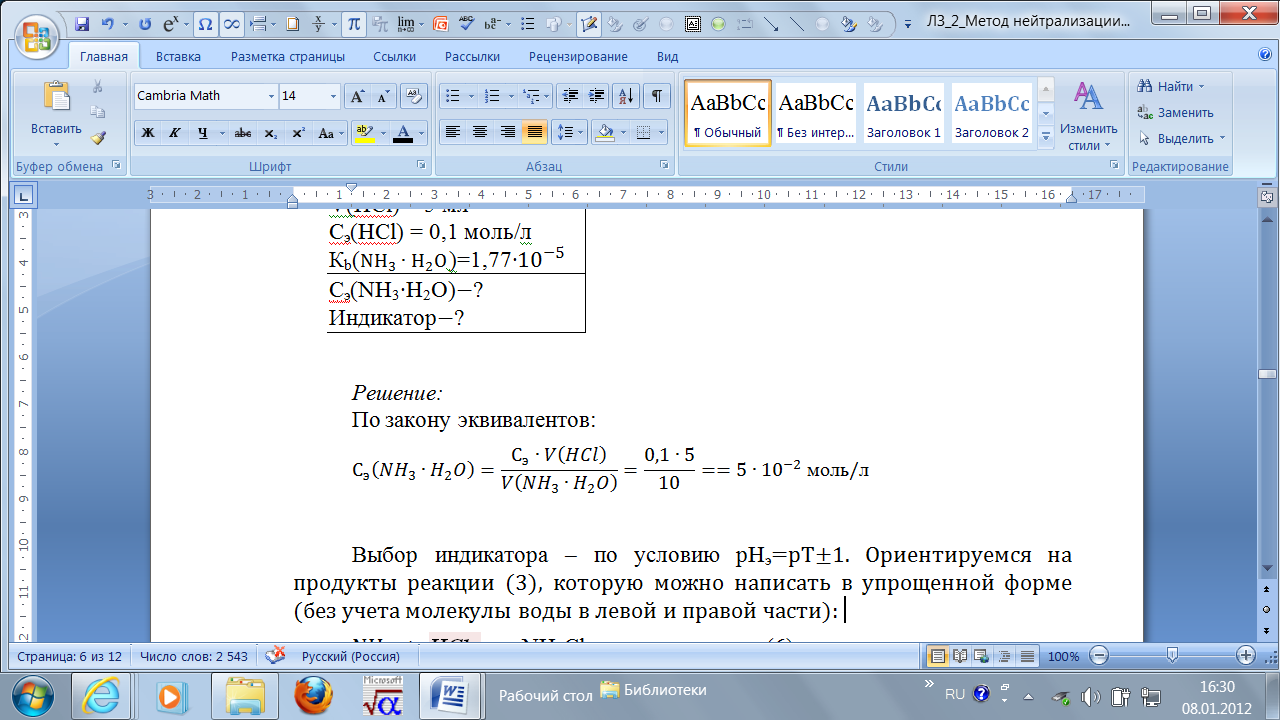 V(NH3∙H2O)=10 мл
V(NH3∙H2O)=10 мл )=1,77∙
)=1,77∙  pH < 7 (7)
pH < 7 (7)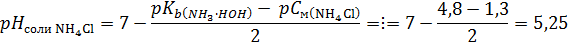



 ; индикатор с рКInd 5,2 – это метиловый красный или бромкрезоловый зеленый.
; индикатор с рКInd 5,2 – это метиловый красный или бромкрезоловый зеленый. (HCl)
(HCl)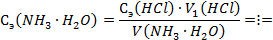
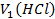 =
= 
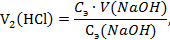
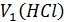 - объем соляной кислоты, пошедший на взаимодействие с NH3 в 1-й реакции;
- объем соляной кислоты, пошедший на взаимодействие с NH3 в 1-й реакции; 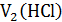 – объем избытка соляной кислоты, израсходованный во 2-й реакции (взаимодействие с титрантом NaOH);
– объем избытка соляной кислоты, израсходованный во 2-й реакции (взаимодействие с титрантом NaOH); 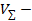 общий объем соляной кислоты, добавляемый к определяемому аммиаку в избытке.
общий объем соляной кислоты, добавляемый к определяемому аммиаку в избытке.


 =
=