Цвет I цвет II
Поэтому каждый индикатор характеризуется определенным значением pKa, или так называемым показателем титрования рТ=рКа=− Таблица 1. Индикаторы
При выборе индикатора руководствуются правилом: значение рН в точке эквивалентности (рНэ) должно попадать в зону перехода цвета индикатора (т.е. рНэ ∋ рТ±1). Значение же рНэ определяется по продуктам реакции, когда в колбочке для титрования уже израсходовано исходное вещество, но еще нет избытка титранта (а есть только продукты реакции). # В методе нейтрализации может быть использовано не только прямое титрование, но и обратное (или титрование по избытку). Его суть: к определяемому веществу добавляется фиксированный избыток стандартного вспомогательного раствора, который затем оттитровывается другим раствором, выполняющим роль титранта. К обратному титрованию прибегают в том случае, когда, например, под рукой нет нужного индикатора для прямого титрования или определяемое вещество слишком летуче. Применение метода нейтрализации (кислотно-основного титрования) для определения кислотности желудочного сока. Введение. Желудочный сок в просвете желудка имеет кислую рН: натощак в норме рН~1,5-2 у взрослого человека и рН~3-4 у новорожденных детей. После приема пищи рН еще ниже. Главный неорганический компонент желудочного сока – соляная кислота, которая вырабатывается обкладочными (париентальными) клетками желудка и находится в просвете желудка в свободном и связанном состоянии (главным образом, с белками). Однако, кроме белков в желудочном соке присутствуют и другие слабые кислоты: бикарбонаты, гидросульфаты, дигидро- и гидрофосфаты, сама фосфорная кислота, уксусная, молочная, пировиноградная, масляная, яблочная и некоторые другие. Поэтому различают три вида кислотности: общую, свободную (обусловленную концентрацией свободных Н+) и связанную (обусловленную наличием недиссоциированных слабых кислот). Определение кислотности желудочного сока. В лаборатории кислотность желудочного сока определяют титрованием его титрованным рабочим раствором NaOH в присутствии индикаторов. Результаты выдаются в титриметрических единицах (т.е.). Одна титриметрическая единица – это объем 0,1э раствора NaOH, который необходимо затратить на титрование 100 мл желудочного сока. Поскольку на исследование берут не 100 мл желудочного сока, а 5-10 мл, и титруют не 0,1э NaOH, а обычно меньшей его концентрацией (например, 0,089э), то при расчете кислотности желудочного сока в титриметрических единицах необходимо делать две поправки: на объем желудочного сока и на концентрацию идеального (0,1э) раствора NaOH. С учетом этих поправок нетрудно вывести общую формулу для расчета кислотности желудочного сока (в титр.ед.):
где # Если рабочий раствор NaOH окажется идеальным – Сэ(NaOH)=0,1моль/л, а объем желудочного сока, взятый на исследование V(ж.сока)=5 мл, то формула для расчета кислотности упрощается: Кислотность ж. сока Указанные формулы применяют для определения любого вида кислотности желудочного сока: свободной кислотности (в присутствии индикатора метилоранжа; он же 4-(4-димеламинофенилазо)бензолсульфонат натрия) или общей кислотности (в присутствии фенолфталеина). В этом случае связанную кислотность определяют по разности общей и свободной кислотности. Обоснование выбора индикаторов. Как уже отмечалось, чтобы в желудочном соке определить две фракции кислотности (свободную и связанную), необходимо проводить титрование в присутствии двух индикаторов. Первым индикатором устанавливается точка эквивалентности для 1-й реакции, когда оттитровывается свободная соляная кислота: 1) HCl + NaOH = H2O + NaCl, или в кратком ионном виде Если бы титровали не желудочный сок, а водный раствор HCl, то рНэ1=7. В желудочном соке же присутствуют еще и слабые кислоты, которые не должны быть затронуты при титровании в первой реакции. Поэтому конец титрования для первой реакции (когда вся HCl будет уже оттитрована) диктуется не продуктом реакции, а тем значением рН, которое создается разбавленными растворами слабых кислот (для примера, уксусная кислота дает рН~3,5). Таким образом, рНэ1= 3,5. Индикатор, зона перехода цвета которого включает точку рНэ13,5 – это метилоранж (4-(4-димеламинофенилазо)бензолсульфонат натрия). # Отсюда, 1-й этап титрования: титруем порцию желудочного сока пока красная окраска раствора не сменится до оранжевой (сработает метилоранж), и отмечаем объем щелочи, пошедшей на титрование. И если его введем в формулу для расчета кислотности, то получим свободную кислотность желудочного сока в титриметрических единицах. Вслед за свободной соляной кислотой оттитровываются слабые кислоты (органические и неорганические). Реакция на примере уксусной кислоты: 2) СН3СООН + NaOH = H2O + CH3COONa СН3СООН + OH− = H2O + CH3COO− рН в точке эквивалентности для второй реакции – это то значение рН, которое обусловлено продуктом реакции - солью, подвергающиеся гидролизу по аниону. Его можно рассчитать, применяя уже рассмотренную формулу (получим рНэ2~ 8,7). Индикатор, зона перехода цвета которого включает точку рНэ28,7 – фенолфталеин. # Отсюда, 2-й этап титрования: продолжаем титровать, пока оранжевая окраска раствора не сменится до ярко малиновой (сработает фенолфталеин). Отмечаем объем щелочи, пошедшей на титрование на втором этапе. И если его введем в формулу для расчета кислотности, то получим связанную кислотность желудочного сока в титриметрических единицах. В этом случае общую кислотность посчитаем как сумму свободной и связанной.
|

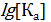 . Вспомним, что рКа – это значение рН среды, при котором содержание кислотной и сопряженной основной формы одинаковы. А это значит, что в точке рТ цвет раствора индикатора будет смешанный. Но глаз человека замечает смешанный цвет и тогда, когда одна из форм индикатора преобладает над другой раз в 10. В этом случае мы получаем зону перехода цвета индикатора рТ±1. При значениях рН< рТ±1 (т.е. левее зоны перехода цвета) индикатор будет находиться главным образом в кислотной своей форме HInd. А при значениях рН> рТ±1 (т.е. правее зоны перехода цвета) будет значительно преобладать его сопряженная основная форма Ind−. В таблице 1 представлены примеры индикаторов и их характеристики.
. Вспомним, что рКа – это значение рН среды, при котором содержание кислотной и сопряженной основной формы одинаковы. А это значит, что в точке рТ цвет раствора индикатора будет смешанный. Но глаз человека замечает смешанный цвет и тогда, когда одна из форм индикатора преобладает над другой раз в 10. В этом случае мы получаем зону перехода цвета индикатора рТ±1. При значениях рН< рТ±1 (т.е. левее зоны перехода цвета) индикатор будет находиться главным образом в кислотной своей форме HInd. А при значениях рН> рТ±1 (т.е. правее зоны перехода цвета) будет значительно преобладать его сопряженная основная форма Ind−. В таблице 1 представлены примеры индикаторов и их характеристики.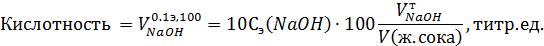
 - это параметры NaOH согласно определению титриметрической единицы;
- это параметры NaOH согласно определению титриметрической единицы; 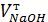 - объем NaOH, затраченный на титрование взятой на исследование пробы желудочного сока (5 – 10 мл, например);
- объем NaOH, затраченный на титрование взятой на исследование пробы желудочного сока (5 – 10 мл, например); 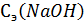 - концентрация титрованного рабочего раствора NaOH.
- концентрация титрованного рабочего раствора NaOH. ,титр. ед.
,титр. ед.


