Роль металлов в регуляции активности ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са2+ служат активаторами фермента протеинкиназы C,катализирующего реакции фосфорилирования белков.Ионы Са2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов.
Витамин В6 предшественник пиридоксальфосфата – принимает участие в образовании эритроцитов, в усвоении нервн кл,глюкозы в обмене жиров Вит РР предшест НАД и НАДФ. Участ в ОВР, вып ф-ю переносчика е и Н Вит В2 предш ФМН и ФАД. Перенос и участие в ОВР. Бх ф-я закл в переносе мжд окис и восст формами
ингибирование активности ферментов - снижение каталитической активности в присутствии определённых веществ - ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными. К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата. Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+). Величину KI = [E]. [I] / [EI], которая представляет собой константу диссоциации комплекса фермента с ингибитором, называют константой ингибирования. Четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катализирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту. В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Эти соединения, будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, с одной стороны, и, с другой - могут использоваться этими же ферментами в качестве псевдосубстратов. Сульфаниламидные препараты, применяемые для лечения инфекционных заболеваний. Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - препарат аспирин.
Аллостерическая регуляция подверг ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют. Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Имеют большое значение в следующих ситуациях: при анаболических процессах, при катаболических процессах, для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты; для координации параллельно протекающих и взаимосвязанных метаболических путей Эффектор, вызывающий снижение активности фермента, называют отрицательным эффектором, или ингибитором. Эффектор, вызываюший повышение активности ферментов, называют положительным эффектором, или активатором. Особенности строения и функционирования аллостерических ферментов:обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;эффекторы присоединяются к ферменту нековалентно в аллостерических центрах;аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. протомер, на котором находится аллостерический центр, - регуляторный протомер.аллостерические ферменты обладают свойством кооперативности; аллостерические ферменты катализируют ключевые реакции данного метаболического пути. конечный продукт может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути:
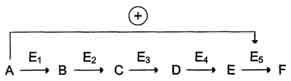
В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути.
Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и распространённый способ химической модификации ферментов - фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами, а дефосфорилирование- фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорил активируются, другие становятся менее активными. Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами фосфопротеинфосфатазами. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды. Антагонистичные по функции гормоны противоположным образом влияют на фосфо-рилирование/дефосфорилирование ферментов, вызывая противоположные эффекты изменения метаболизма клетки. Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза гликогена и усиление его распада, вызванного фосфорилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых
|