Термическое равновесие (все части системы находятся при одинаковой температуре) есть необходимое условие термодинамического равновесия.
Термическое уравнение состояния: V = f (T, P, ni), (3.1) например, V= (RT/P)Σ ni – для идеального газа. Калорическое уравнение состояния: U= f (T, V, ni)(3.1а) Термодинамика основана на установленных опытным путем законах, так называемых началах, откуда могут быть выведены все зависимости между термодинамическими величинами. Первое начало термодинамики(частный случай закона сохранения энергии): В закрытой системе изменение внутренней энергии Δ U равно разности теплоты Q, поглощенной системой из окружающей среды, и работы A, произведенной системой над окружением: Δ U = Q − A (3.2) Первое начало термодинамики исключает возможность создания вечного двигателя первого рода, который при помощи кругового процесса (Δ U = 0)совершал бы работу большую подводимой извне энергии в форме тепла (А = Q). Работа А в большинстве случаев совершается в форме работы расширения А = P Δ V. Дифференциальная форма 1-го начала для этого случая имеет вид: δ Q = dU + P dV. (3.2')
Второе начало термодинамики взаимосвязано с определением энтропии. Её изменение Δ S выражается через поглощенную системой теплоту для обратимо протекающего процесса в закрытой системе: Δ S = В соответствующем необратимом процессе с присущими ему внутренними теплопотерями, в частности, на трение количество поглощенной и «усвоенной» системой теплоты будет меньше, а изменение энтропии от начального до конечного состояния будет больше соответствующего необратимому процессу интеграла: Δ S > Поскольку все процессы в природе в той или иной степени необратимы, то в изолированной системе (
|

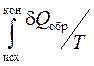 . (3.3)
. (3.3) . (3.3')
. (3.3')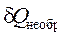 = 0 ), в которой протекают самопроизвольные, т.е. необратимые процессы, всегда наблюдается увеличение энтропии (Δ S > 0) .
= 0 ), в которой протекают самопроизвольные, т.е. необратимые процессы, всегда наблюдается увеличение энтропии (Δ S > 0) .


