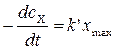Скорость, определяемая диффузионным потоком реагента на поверхность реагирования равна скорости его химического превращения
Первое из равенств – это упрощенная форма диффузионного закона Фика, определяющего диффузионный поток реагента на поверхность, второе – это кинетический закон действующих масс для реакции (3.67), определяющий поток превращающихся молекул А. Выражая rS = kS c' и использовании определения скорости гетерогенной реакции (3.68) дает уравнение
Полученный результат дает количественные закономерности протекания практически важных гетерогенных реакций. 1) Скорость реакции пропорциональна отношению S/V. 2) При kS >> b Þ 3) При kS << b Þ 4) При kS» bконстанта скорости процесса в смешанном диффузионно-кинетическом режиме рассчитывается по общей формуле (3.70). В заключение этого раздела укажем на различие констант скоростей: с одной стороны, истинно поверхностной kS, м/с, а с другой, - эффективно-объёмной (3.70), 1/с, которая дополнительно учитывает гидродинамическую обстановку в прилегающем объёме за счет зависимости l от скорости обтекания поверхности.
Катализ – изменение скорости химической реакции в присутствии веществ (катализаторов), вступающих в промежуточные химические взаимодействия с участниками реакции, но восстанавливающих свой состав после каждого цикла промежуточных взаимодействий. Положительные катализаторы ускоряют химическую реакцию, а отрицательные катализаторы или ингибиторы её замедляют. Селективность катализатора – его способность благоприятствовать протеканию одной реакции из ряда параллельных конкурирующих реакций. Гомогенный или гетерогенный катализ – катализатор и участник реакции находятся в одной или разных фазах. Способ действия катализатора заключается в понижении энергией активации, что влечет за собой повышение скорости реакции. Катализаторы в большинстве случаев образуют с одним из участников реакции реакционноспособное промежуточное соединение, которое далее реагирует с выделением катализатора. Обычно каталитическая реакция имеет 1-ый порядок по отношению к концентрации катализатора. Принцип понижения энергии активации Еа иллюстрирует рис. 3.5. Еа для обеих промежуточных стадий катализируемой реакции меньше, чем для некатализируемой. Катализаторы могут изменять лишь скорость реакции, но не положение равновесия реакции.
3.16.1. Гомогенный катализ, при котором катализатор и участник реакции находятся в одной фазе, обычно реализуется в газах и растворах, например: 2NO + O2 ® 2NO2 (промежуточное соединение) NO2 + SO2 ® SO3 + NO │ *2 2 SO2 + O2 Кислотно-основной катализ характерен для реакций в растворах: · При катализе кислотами протон от катализатора передается участнику реакции. Возникшее промежуточное соединение далее реагирует с отдачей протона, при этом восстанавливается катализатор. · У основных катализаторов, напротив, протон переходит от участника реакции к катализатору. Катализатор при автокатализе образуется лишь в ходе реакции. Скорость реакции сначала возрастает вследствие накопления катализатора, а затем снова падает в результате расходования исходного вещества или катализатора. 3.16.2. Механизм гетерогенного катализа включает хемосорбцию одного или нескольких участников реакции на поверхность катализатора с образованием поверхностных соединений, у которых определенные связи ослаблены, а сами молекулы становятся более реакционносособными. Такой механизм реакции требует меньшей энергии активации, чем аналогичная некатализируемая гомогенная реакция. Некоторые вещества могут очень прочно адсорбироваться на поверхности катализатора и уменьшать его активность (контактные яды H2S, CO, HCN и др.). Выделяют следующие стадии гетерогенного катализа: 1) диффузия (или конвекция) участников реакции к поверхности катализатора; 2) адсорбция (хемосорбция) участников реакции на поверхности; 3) химические реакции между адсорбированными веществами; 4) десорбция продуктов реакции; 5) обратная диффузия (или конвекция) продуктов реакции из зоны реакции. Подчеркнутые стадии трудно разделить, они являются самыми медленными и определяют скорость процесса.
Рис. 3.6. Основные стадии реакции X ® Y на поверхности катализатора (К): хемосорбция реакция десорбция К + X ® К×X ® К×Y ® К + Y.
В области давлений между обоими граничными случаями получают дробный порядок реакции между 0 и 1.
Многие поверхностно катализируемые реакции при повышенных температурах могут также параллельно протекать в виде соответствующих гомогенных газовых реакций. На практике катализаторы внедряют в структуру определенных веществ ("носителей"). Благодаря этому достигается увеличение поверхности, и затрудняются нежелательные эффекты рекристаллизации или спекания катализатора. Малые добавки некоторых веществ (часто – веществ-носителей) могут повысить каталитическую активность катализатора. Биологически действующими катализаторами являются энзимы, или ферменты (в большинстве случаев – в коллоидной форме). Они состоят из вещества-носителя (чаще всего – белковоподобного тела) и собственно активной группы. Носители, как правило, повышают активность катализатора. Каталитическое действие энзимов характеризуется резко повышенной селективностью.
|




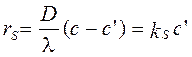 . (3.69)
Величина b= D /l носит название коэффициента массоотдачи, который равен коэффициенту диффузии, деленному на толщину диффузионного слоя l (см. рис. 3.4), в котором происходит изменение концентрации от её значения в объёме (c)до значения на поверхности реагирования (с').
. (3.69)
Величина b= D /l носит название коэффициента массоотдачи, который равен коэффициенту диффузии, деленному на толщину диффузионного слоя l (см. рис. 3.4), в котором происходит изменение концентрации от её значения в объёме (c)до значения на поверхности реагирования (с').
 из последнего равенства в (3.69), получаем концентрацию
из последнего равенства в (3.69), получаем концентрацию  , которая при подстановке в кинетическое уравнение
, которая при подстановке в кинетическое уравнение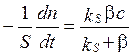 . Его умножение на S и деление на V приводит к уравнению, формально соответствующему уравнению объемной реакции 1-го порядка и определяет эффективную константу скорости такой реакции.
. Его умножение на S и деление на V приводит к уравнению, формально соответствующему уравнению объемной реакции 1-го порядка и определяет эффективную константу скорости такой реакции. ,
, 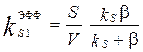 . (3.70)
. (3.70) = b S / V реализуется, так называемый, диффузионный режим быстрой химической реакции, когда скорость процесса лимитируется диффузионной доставкой или отводом компонентов.
= b S / V реализуется, так называемый, диффузионный режим быстрой химической реакции, когда скорость процесса лимитируется диффузионной доставкой или отводом компонентов.
 2 SO3
2 SO3
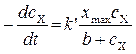 . Размерность
. Размерность  .
x max – максимальная поверхностная концентрация; k', b – постоянные, зависящие от температуры.
.
x max – максимальная поверхностная концентрация; k', b – постоянные, зависящие от температуры.