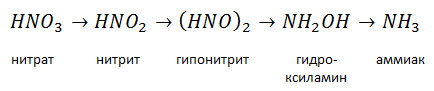Азотные удобрения
Азоту принадлежит ведущая роль в повышении урожая сельскохозяйственных культур. Д. Н. Прянишников подчеркивал, что главным условием, определяющим урожай, является степень обеспеченности сельскохозяйственных растений азотом. Азот входит в состав белков, являющихся главной составной частью цитоплазмы и ядра клеток, в состав нуклеиновых кислот, хлорофилла, ферментов, фосфатидов, большинства витаминов и других органических азотистых соединений, которые играют важную роль в процессах обмена веществ в растении. Поступившие в растения минеральные формы азота проходят сложный цикл превращений, в конечном итоге включаясь в состав органических азотистых соединений — аминокислот, амидов и, наконец, белка. Синтез органических азотистых соединений происходит через аммиак, образованием его завершается и их распад. Аммиак, по выражению Д. Н. Прянишникова, «...есть альфа и омега в обмене азотистых веществ у растений». Нитратный азот не может непосредственно использоваться растениями для синтеза аминокислот. Нитраты в растениях подвергаются ступенчатому ферментативному восстановлению через нитрит, гипонитрит и гидроксиламин восстановлению до аммиака:
Восстановление нитратов в растениях осуществляется по мере использования образующегося аммиака на синтез органических азотистых соединений. Нитраты безвредны для растений и могут накапливаться в их тканях в значительных количествах. Однако содержание нитратов в сельскохозяйственной продукции (кормах и овощах) выше определенного предела может оказывать токсическое действие на организм животных и человека. Наряду с синтезом в растениях происходит распад белков на аминокислоты с отщеплением аммиака под действием протеолитических ферментов. В молодых растущих органах и растениях синтез белков превышает распад, по мере старения процессы расщепления активизируются и начинают преобладать над синтезом. При достаточном снабжении растений азотом в них усиливается синтез органических азотистых веществ. Растения образуют мощные листья и стебли с интенсивно-зеленой окраской, хорошо растут и кустятся; улучшается формирование и развитие органов плодоношения. В результате резко повышаются урожай и содержание белка в нем. Однако при одностороннем избытке азота задерживается созревание растений, они образуют большую вегетативную массу, но мало зерна или клубней и корнеплодов; у зерновых и льна избыток азота может вызывать полегание. При недостатке азота рост растений резко замедляется, листья бывают мелкие, бледно-зеленой окраски, что связано с нарушением синтеза хлорофилла, преждевременно желтеют, стебли становятся тонкими и слабо ветвятся. Ухудшаются также формирование и развитие репродуктивных органов и налив зерна, сильно снижаются урожай и содержание белка в нем. По химическому составу азотные удобрения подразделяются на четыре группы: - аммиачные удобрения – содержат азот в аммиачной форме: жидкий (безводный) аммиак NH3, аммиачная вода (раствор аммиака в воде). Жидкий аммиак - самое концентрированное безбаластное удобрение с содержанием азота 82,3%. Получается сжижением газообразного аммиака под давлением. При хранении в открытых сосудах быстро испаряется. Поэтому его хранят и перевозят в специальных толстостенных стальных цистернах, рассчитанных на давление 25-30 атм. Вследствие большой упругости паров емкости для хранения и транспортировки жидкого аммиака заполняются не полностью. Жидкий аммиак корродирует медь, цинк и их сплавы, но практически нейтрален по отношению к железу, чугуну, стали. Аммиачная вода (водный аммиак) —первый сорт этого удобрения содержит 20,5% азота (25%-й аммиак), второй -16,4% азота (20%-й аммиак). Аммиачная вода имеет невысокое давление, не разрушает черные металлы. Поэтому для работы с ней используют резервуары из обычной углеродистой стали. Азот в аммиачной воде содержится в форме аммиака (NH3) и аммония (NH4OH): NH3 + H2O=NH4OH (или NH3·H2O). Причем свободного аммиака содержится значительно больше, чем аммония, что обусловливает возможные потери азота за счет улетучивания. Работать с аммиачной водой проще, чем с безводным аммиаком, но она малотранспортабельна в связи с низким содержанием азота, поэтому аммиачную воду экономичнее применять в хозяйствах, расположенных вблизи предприятий, производящих это удобрение. - аммонийные удобрения – содержат азот в аммонийной форме: сульфат аммония (NH4)2SO4, хлорид аммония (нашатырь) NH4Cl, сульфат аммония-натрия NаNH4SO4. Сульфат аммония содержит 20,5% азота и представляет собой кристаллический продукт белого или серого цвета, хорошо растворимый в воде. Физиологически кислое удобрение, поэтому целесообразно его применение на почвах, насыщенных основаниями. Также важной составляющей этого удобрения является сера, которая в входит в состав белков и таких незаменимых аминокислот как метионин и цистин. Получают взаимодействием серной кислоты с аммиаком: Н2SО4+2NH3=(NH4)2SO4. Хлорид аммония содержит до 25% азота, представляет собой белый кристаллический порошок, хорошо растворяется в воде. Физиологически кислое удобрение, используется для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свекла, рис, кукуруза). Пищевая добавка хлорид аммония Е510 является эмульгатором, загустителем и улучшителем свойств муки. В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия: NH3+H2O+CO2+NaCl = NaHCO3+NH4Cl. - амидные удобрения – содержат азот в амидной форме: мочевина, или карбамид CO(NH2)2. Мочевина содержит 46% азота. Это самое концентрированное из твердых азотных удобрений. Азот в мочевине находится в органической форме в виде амида карбаминовой кислоты СO(NH2)OH. Имеет вид гранул, хорошо растворима в воде. Мочевина - конечный продукт обмена белков у большинства животных организмов, включая человека. В почве она растворяется и под действием фермента уреазы превращается в диоксид углерода и аммиак: CO(NH2)2+H2O→CO2+2NH3. Мочевина в промышленности получается в результате взаимодействия углекислого газа и аммиака при высоком давлении и темᴨературе: CO2+2NH3= СО(NH2)2+H2O. - нитратные удобрения - содержат азот в нитратной форме: натриевая (чилийская) селитра NaNO3, кальциевая селитра Ca(NO3)2. Натриевая селитра представляет собой бесцветные прозрачные кристаллы с резким горько-соленым вкусом. Хорошо растворима в воде. Вᴨервые это вещество было использовано как удобрение в 1825 г в Гамбурге. Натриевую селитру также применяют в пищевой промышленности (консервант Е251), в металлургии, в стекольной промышленности. Добывается из природных залежей в Чили, поэтому еще известна под названием чилийской селитры. В промышленности получают путем адсорбции оксилов азота раствором щелочи с последующим окислением образовавшихся нитритов натрия азотной кислотой: 2NaOH + NO + NО2 = 2NaNО2 + H2О
2NaOH + 2NО2 = NaNО3 + NaNО2 + H2О
3NaNО2 + 2HNО3 = 3NaNО3 + 2NO + Н2О Другой способ получения основан на обменной реакции между нитратами кальция или аммония с хлоридом, сульфатом или карбонатом натрия: 2CaNO3+2NaCl=2NaNO3+CaCl2
Ca(NО3)2 + Na2SО4 = 2NaNО3 + CaSО4
2NH4NО3+Na2CО3 = 2NaNО3 + (NH4)2CО3
- аммонийно-нитратные удобрения – содержат азот в аммонийной и нитратной форме: аммиачная селитра NH4NО3 . Аммиачная селитра содержит 34-35% азота и является наиболее распространенной формой азотных удобрений. Соль бесцветна, гигроскопична, имеет вид гранул. Физиологически кислое удобрение. Получают при нейтрализации азотной кислоты аммиаком: NH3+HNO3=NH4NO3.
|