Опыт 1. Зависимость поляризуемости изоэлектронных катионов от их заряда и радиуса иона.
В одну пробирку налейте 2-3 мл. раствора  (желтый осадок), в другую – раствора
(желтый осадок), в другую – раствора  . В каждую из пробирок добавьте немного раствора
. В каждую из пробирок добавьте немного раствора  (до выпадения осадков). Запишите уравнения реакций в ионной форме.
(до выпадения осадков). Запишите уравнения реакций в ионной форме.
Имеют ли окраску катионы 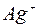 и
и  в растворах нитратов серебра и кадмия? Какой цвет имеют кристаллические вещества
в растворах нитратов серебра и кадмия? Какой цвет имеют кристаллические вещества 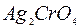 и
и  ? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости катионов
? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости катионов 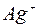 и
и  в кристаллических решетках хроматов серебра и кадмия.
в кристаллических решетках хроматов серебра и кадмия.
В табл. 4.1 запишите результаты наблюдений, общий вывод и характеристики катионов: электронную формулу внешнего квантового слоя и величины радиусов r (табл. 5.1).
Убеждаемся, что катионы  и
и 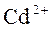 являются изоэлектронными, значения радиусов их достаточно близки, но один из них обладает меньшим положительным зарядом, и, следовательно, большой поляризуемостью (значения
являются изоэлектронными, значения радиусов их достаточно близки, но один из них обладает меньшим положительным зарядом, и, следовательно, большой поляризуемостью (значения  см. в табл. 5.2).
см. в табл. 5.2).
Таблица 4.1
| КАТИОН
| ЭЛЕКТРОННАЯ ФОРМУЛА ВНЕШНЕГО КВАНТОВОГО СЛОЯ
| r, 
| ЦВЕТ И ФОРМУЛА ОСАДКА СОЛИ
| ВЫВОД
|
Опыт 2. Зависимость поляризуемости изоэлектронных анионов от их заряда и радиуса иона.
В две пробирки налейте по 2-3 мл раствора 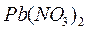 . В одну из них добавьте немного раствора
. В одну из них добавьте немного раствора  в другую – раствора
в другую – раствора 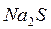 (до выпадения осадков).
(до выпадения осадков).
Имеют ли окраску анионы  и
и  в растворах хлорида натрия и сульфида натрия? Какой цвет имеют кристаллические вещества
в растворах хлорида натрия и сульфида натрия? Какой цвет имеют кристаллические вещества 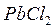 и
и  ? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости анионов
? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости анионов  и
и  в кристаллических решетках хлорида и сульфида свинца.
в кристаллических решетках хлорида и сульфида свинца.
В табл. 4.2 запишите результаты наблюдений, общий вывод и характеристики анионов: электронную формулу внешнего квантового слоя и величину радиусов r (см. табл. 5.1).
Убеждаемся, что анионы  и
и  являются изоэлектронными, радиусы их близки по величине, но один из анионов обладает большим отрицательным зарядом, и, следовательно, большей поляризуемостью под действием поляризующего катиона
являются изоэлектронными, радиусы их близки по величине, но один из анионов обладает большим отрицательным зарядом, и, следовательно, большей поляризуемостью под действием поляризующего катиона  (значение a см. табл. 5.2).
(значение a см. табл. 5.2).
Таблица 4.2
| АНИОН
| ЭЛЕКТРОННАЯ ФОРМУЛА ВНЕШНЕГО КВАНТОВОГО СЛОЯ
| r, 
| ЦВЕТ И ФОРМУЛА ОСАДКА СОЛИ
| ВЫВОД
|
Опыт 3. Зависимость растворимости солей от взаимной поляризации ионов в кристаллической решетке.
Полученные во втором опыте осадки PbCl2 и PbS обладают различной растворимостью. Нагрейте пробирки с этими осадками (или добавьте в них горячей воды). Какой из осадков растворяется при нагревании (следовательно, характеризуется большей долей ионной связи в кристаллической решетке)?
В табл. 4.3 запишите результаты наблюдений и общий вывод. Рассчитайте, какая разность между величинами ЭО (Dχ) существует в соединениях PbCl2 и PbS, и какой доле ионной связи она соответствует (табл. 5.3, 5.4). Убеждаемся, что доля ионной связи в соединении 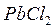 значительно выше.
значительно выше.
Таблица 4.3
| ФОРМУЛА ОСАДКА СОЛИ
|  ЭО ЭО
| ДОЛЯ ИОННОЙ СВЯЗИ В %
| РАСТВОРИМОСТЬ
ОСАДКА СОЛИ В ГОРЯЧЕЙ ВОДЕ
| ВЫВОД
|
Опыт 4. Зависимость поляризуемости однозарядных аналогичных электронных анионов от величины их радиусов.
В три пробирки налейте по 2-3 мл раствора 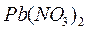 . В одну добавьте раствор
. В одну добавьте раствор  , в другую KBr, в третью – раствор KI (до выпадения осадков). Имеют ли окраску анионы
, в другую KBr, в третью – раствор KI (до выпадения осадков). Имеют ли окраску анионы  ,
,  ,
,  в растворах хлорида, бромида и иодида калия? Какой цвет имеют кристаллические вещества
в растворах хлорида, бромида и иодида калия? Какой цвет имеют кристаллические вещества  ,
,  ,
,  ? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости анионов
? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости анионов  ,
,  ,
,  в кристаллических решетках хлорида, бромида и иодида свинца.
в кристаллических решетках хлорида, бромида и иодида свинца.
В табл. 4.4 запишите результаты наблюдений, вывод и характеристики анионов: электронную формулу внешнего квантового слоя и величины их радиусов (табл. 5.1).
Убеждаемся, что анионы  ,
,  ,
,  являются изоэлектронными, обладают одинаковым отрицательным зарядом, но различными величинами радиусов. Один из анионов имеет наибольший радиус, следовательно, характеризуется наибольшей поляризуемостью под действием поляризующего катиона
являются изоэлектронными, обладают одинаковым отрицательным зарядом, но различными величинами радиусов. Один из анионов имеет наибольший радиус, следовательно, характеризуется наибольшей поляризуемостью под действием поляризующего катиона  (значения a и ПП см. в табл. 5.2).
(значения a и ПП см. в табл. 5.2).
Таблица4. 4
| АНИОН
| ЭЛЕКТРОННАЯ ФОРМУЛА ВНЕШНЕГО КВАНТОВОГО СЛОЯ
| r, 
| ЦВЕТ И ФОРМУЛА ОСАДКА СОЛИ
| ВЫВОД
|
Опыт 5. Зависимость цветности комплексных ионов меди от поляризуемости молекул лигандов.
Налейте немного воды в пробирку и растворите в ней небольшое количество безводного сульфата меди  . Какой цвет имеет это кристаллическое вещество и какой цвет приобретает раствор? Добавьте в эту же пробирку несколько капель концентрированного раствора
. Какой цвет имеет это кристаллическое вещество и какой цвет приобретает раствор? Добавьте в эту же пробирку несколько капель концентрированного раствора  (
( ). Как изменится окраска раствора? Напишите в ионной форме уравнения реакций образования комплексных ионов [
). Как изменится окраска раствора? Напишите в ионной форме уравнения реакций образования комплексных ионов [  ]
]  и [
и [ 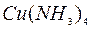 ]
]  .
.
Запишите в табл. 4.5 результаты наблюдений и характеристики поляризуемости и поляризующего действия катиона  , а также поляризуемости молекул
, а также поляризуемости молекул 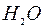 и
и  (смотри таблицу 5.2). Сделайте вывод о зависимости между интенсивностью окраски полученных комплексных ионов и поляризуемостью молекул – лигандов
(смотри таблицу 5.2). Сделайте вывод о зависимости между интенсивностью окраски полученных комплексных ионов и поляризуемостью молекул – лигандов 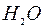 и
и  . В данном опыте проявляется поляризующее действие катиона
. В данном опыте проявляется поляризующее действие катиона  ,поляризуемость которого весьма невилика,а поляризующее действие значительно выше 9 см3 (табл. 5.2).
,поляризуемость которого весьма невилика,а поляризующее действие значительно выше 9 см3 (табл. 5.2).
Таблица 4.5
| КАТИОН
| ЭЛЕКТРОННАЯ ФОРМУЛА ВНЕШНЕГО КВАНТОВОГО СЛОЯ
| a
| ПП
| ЦВЕТ В КРИСТАЛЛИЧ. ВЕЩЕСТВЕ
| ФОРМУЛА И ЦВЕТ КОМПЛЕКС-НОГО ИОНА
| ВЫВОД
|

 (желтый осадок), в другую – раствора
(желтый осадок), в другую – раствора  . В каждую из пробирок добавьте немного раствора
. В каждую из пробирок добавьте немного раствора  (до выпадения осадков). Запишите уравнения реакций в ионной форме.
(до выпадения осадков). Запишите уравнения реакций в ионной форме.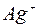 и
и  в растворах нитратов серебра и кадмия? Какой цвет имеют кристаллические вещества
в растворах нитратов серебра и кадмия? Какой цвет имеют кристаллические вещества 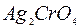 и
и  ? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости катионов
? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости катионов  и
и 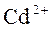 являются изоэлектронными, значения радиусов их достаточно близки, но один из них обладает меньшим положительным зарядом, и, следовательно, большой поляризуемостью (значения
являются изоэлектронными, значения радиусов их достаточно близки, но один из них обладает меньшим положительным зарядом, и, следовательно, большой поляризуемостью (значения  см. в табл. 5.2).
см. в табл. 5.2).
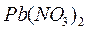 . В одну из них добавьте немного раствора
. В одну из них добавьте немного раствора  в другую – раствора
в другую – раствора 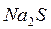 (до выпадения осадков).
(до выпадения осадков). и
и  в растворах хлорида натрия и сульфида натрия? Какой цвет имеют кристаллические вещества
в растворах хлорида натрия и сульфида натрия? Какой цвет имеют кристаллические вещества 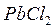 и
и  ? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости анионов
? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости анионов  в кристаллических решетках хлорида и сульфида свинца.
в кристаллических решетках хлорида и сульфида свинца. (значение a см. табл. 5.2).
(значение a см. табл. 5.2). ЭО
ЭО
 , в другую KBr, в третью – раствор KI (до выпадения осадков). Имеют ли окраску анионы
, в другую KBr, в третью – раствор KI (до выпадения осадков). Имеют ли окраску анионы  ,
,  в растворах хлорида, бромида и иодида калия? Какой цвет имеют кристаллические вещества
в растворах хлорида, бромида и иодида калия? Какой цвет имеют кристаллические вещества  ,
,  ,
,  ? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости анионов
? По интенсивности окраски полученных солей сделайте вывод о сравнительной поляризуемости анионов  в кристаллических решетках хлорида, бромида и иодида свинца.
в кристаллических решетках хлорида, бромида и иодида свинца. (значения a и ПП см. в табл. 5.2).
(значения a и ПП см. в табл. 5.2). . Какой цвет имеет это кристаллическое вещество и какой цвет приобретает раствор? Добавьте в эту же пробирку несколько капель концентрированного раствора
. Какой цвет имеет это кристаллическое вещество и какой цвет приобретает раствор? Добавьте в эту же пробирку несколько капель концентрированного раствора  (
( ). Как изменится окраска раствора? Напишите в ионной форме уравнения реакций образования комплексных ионов [
). Как изменится окраска раствора? Напишите в ионной форме уравнения реакций образования комплексных ионов [  ]
]  и [
и [ 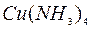 ]
]  , а также поляризуемости молекул
, а также поляризуемости молекул 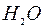 и
и  (смотри таблицу 5.2). Сделайте вывод о зависимости между интенсивностью окраски полученных комплексных ионов и поляризуемостью молекул – лигандов
(смотри таблицу 5.2). Сделайте вывод о зависимости между интенсивностью окраски полученных комплексных ионов и поляризуемостью молекул – лигандов 


