Энтропия.
Кроме внутренней энергии, являющейся функцией состояния системы, в термодинамике используются и другие физические величины, также являющиеся функциями состояния. Одна из них - энтропия. Она определяется следующим образом. Пусть
где индекс “обр” означает, что процесс получения тепла является обратимым. Разность энтропий в состояниях 1 и 2 равна
Как и внутренняя энергия энтропия определяется с точностью до произвольной постоянной, значение которой не играет роли. Физический смысл имеет не сама энтропия, а лишь разность ее в двух состояниях. В термодинамике доказывается, что энтропия замкнутой системы не может убывать, т. е.
где знак “=” относится к обратимому процессу, знак “>” - к необратимому. Это утверждение называется законом неубывания энтропии, который фактически является еще одной формулировкой второго начала термодинамики. Нернстом было доказано, что энтропию любой системы при Т=0 необходимо принимать равной нулю. Это утверждение называют третьим началом термодинамики или тепловой теоремой Нернста. В соответствии с этим энтропию при произвольной температуре Т находят как
|

 - элементарное количество теплоты, сообщенное системе, а Т - температура, при которой оно было получено. Энтропией системы S называется функция ее состояния, такая что
- элементарное количество теплоты, сообщенное системе, а Т - температура, при которой оно было получено. Энтропией системы S называется функция ее состояния, такая что ,
, .
. ,
,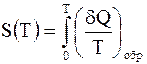 .
.


