Второй постулат Бора: правило частот
Частота излучения равна: vkn = (Ek - En) / h = (Ek / h) - (En / h) Или, длина волны излучения λ равна: 1 / λkn = (1 / hc) (Ek - En) Где h – постоянная Планка, с – скорость света в вакууме. Если Ek > En, то происходит излучение фотона, если Ek < En, то происходит поглощение фотона, при котором атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. Таким образом, для каждого атома имеется ряд строго определённых дискретных значений энергии, которыми он может обладать. Физические величины, например энергия и импульс, которые могут принимать лишь дискретные (квантовые) значения, носят название квантованные физические величины (квантование физических величин). При этом энергетические уровни атома – это возможные значения энергии атома. Правило квантования орбит позволяет определить радиусы стационарных орбит: из всех орбит электрона возможны только те, для которых момент импульса равен целому кратному постоянной Планка mvnrn = nh' где n = 1, 2, 3…, m – масса электрона, rn – радиус n-ой орбиты, vn – скорость электрона на этой орбите. Число n – положительное число, которое называется главное квантовое число. Величина (mvn)rn – момент импульса электрона. h' – это величина, которая равна: h' = h/2π = 1,05445887•10-34 Дж•с где h – постоянная Планка. Главное квантовое число указывает номер орбиты, по которой может обращаться электрон. Свои постулаты Н.Бор применил для построения теории простейшей атомной системы – атома водорода, состоящего из ядра – протона, и одного электрона. Эта теория также применима для водородоподобных ионов, то есть атомов с зарядом ядра Ze и потерявших все электроны, кроме одного (например, Li2+, Be3+ и т.п.). В предположении, что электрон движется по круговой орбите, постулаты Бора позволяют найти радиусы rn стационарных, возможных орбит электрона. На электрон действует кулоновская сила: Fk = (1 / 4πε0) (ε2 / rn2) Где е – модуль заряда электрона, равный заряду ядра, ε0 = 8,85418782 * 10-12 Ф/м – электрическая постоянная в единицах СИ. Кулоновская сила сообщает электрону на орбите центростремительное ускорение: aцс = (vn2) / rn Согласно второму закону Ньютона: Fk = maцс Поэтому (mvn2) / rn = e2 / (4πε0rn2) Или mvn2rn = e2 / (4πε0) Используя правило квантования орбит mvnrn = nh', можно получить выражения для возможных радиусов орбит. Исключая скорость vn из предыдущего выражения, получим: rn = 4πε0n2h' / me2 (так как h' = h / 2π) Таким образом, радиусы орбит электрона в атоме водорода прямо пропорциональны квадратам главного квантового числа n. Наименьший радиус орбит при n = 1, то есть радиус первой орбиты в атоме водорода равен: r1 = 4πε0h' / me2 = 0,528 * 10-10 м = 0,528 Å Радиус первой орбиты в атоме водорода носит название первый Боровский радиус и служит единицей длины в атомной физике. Полная энергия Е электрона в атоме водорода, согласно механике Ньютона, равна сумме кинетической энергии Еk и потенциальной энергии П взаимодействия электрона с ядром: E = Еk - П = (mvn2 / 2) - (e2 / 4πε0rn) Потенциальная энергия электрона в атоме отрицательна: П = - (e2 / 4πε0rn) Так как нулевой уровень отсчёта берётся на бесконечности (рис. 1.3), а по мере приближения электрона к ядру его потенциальная энергия уменьшается. Взаимодействующие частицы – ядро и электрон – имеют заряды противоположных знаков.
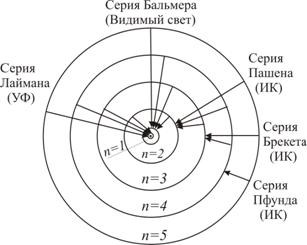
Рис. 1.3. Потенциальная энергия электрона в атоме. Подставляя значение скорости vn2 = - e2 / 4πε0mrn в выражение полной энергии, получим: E = (m / 2) (e2 / 4πε0mrn) - (e2 / 4πε0rn) Подставляя в эту формулу выражение для радиусов орбит, получим энергетические уровни электрона в атоме водорода (значения энергий стационарных состояний атома): En = -(1 /(4πε0)2) me4 / 2h'2n2 = - (me4 / 8h2ε02) * (1 / n2), n = 1,2,3… Энергия Еn электрона в атоме водорода зависит от главного квантового числа n, которое определяет энергетические уровни электрона в атоме водорода. Основное энергетическое состояние атома (нормальное состояние атома) – это энергетический уровень при n = 1. Значение энергии, соответствующее первому (низшему) энергетическому уровню в атоме водорода равно: E1 = -(1 /(4πε0)2) me4 / 2h'2λ = -2,485 * 10-19 Дж = -13,53 эВ В этом состоянии атом может находиться сколько угодно долго. Для того чтобы ионизировать атом водорода, ему нужно сообщить энергию 13,53 эВ, которая называется энергия ионизации. Энергетические уровни при n > 1 – это возбуждённые энергетические состояния (возбуждённые состояния атома). Возбуждённое состояние атома является менее устойчивым, чем основное состояние. Время жизни атома в этом состоянии имеет порядок 10-8 секунд. За это время электрон успевает совершить около ста миллионов оборотов вокруг ядра. При переходе электрона с удалённой от ядра стационарной k -орбиты на ближайшую n -ую орбиту атом излучает фотон, энергия которого hvnk согласно второму постулату Бора определяется: hvkn = Ek - En = -(1 / (4πε0)2) * (me4 / 2h'2) * [(1 / n2) - (1 / k2)] = (me4 / 8h2ε02) * [(1 / n2) - (1 / k2)] Частота излучения атома водорода: vkn = (1 / (4πε0)2) * (me4 / h'3) * [(1 / n2) - (1 / k2)] = R[(1 / n2) - (1 / k2)] Где R = (me4 / (4πε0)2) * 4πh'3) = (me4 / 8h3ε02) = 3,288 * 1015 c-1- постоянная Ридберга Постоянная Ридберга определяется через постоянную Планка, массу и заряд электрона. Длина волны излучения определяется соотношением: 1 / λnk = vnk / c = (me4 / 8ε02h3c) * [(1 / n2) - (1 / k2)] = Rc[(1 / n2) - (1 / k2)] Где Rc = R / c = 1,0974 * 107 м-1 - также постоянная Ридберга с = 3*108 м/с – скорость света в вакууме. Теоретическое значение R совпадает с экспериментальным значением, полученным из спектроскопических измерений. Энергия обычно измеряется в электронвольтах (эВ). Электронвольт – это значение энергии, которую приобретает электрон, пройдя ускоряющую разность потенциалов в 1 В: 1 эВ = 1,6 * 10-19 Кл * 1В = 1,6 * 10-19 Дж
Рассмотрим электрон (рис. 6.6,а), движущийся со скоростью в поле атомного ядра с зарядом Ze (при Z = 1 – атом водорода)
Подставим значение υ из (6.3.2) в (6.3.3) и получим выражение для радиусов стационарных орбит (рис.6.6,б): Схема энергетических уровней, определяемых уравнением (6.3.6) показана на рис. 6.1 и 6.7.
Однако, наряду с успехами, в теории Бора с самого начала обнаружились существенные недостатки. Главнейшим из них была внутренняя противоречивость теории: механическое соединение классической физики с квантовыми постулатами. Теория не могла объяснить вопрос об интенсивностях спектральных линий. Серьезной неудачей являлась абсолютная невозможность применить теорию для объяснения спектров атома гелия, содержащего два электрона на орбите и тем более для многоэлектронных атомов (рис. 6.8).
|