Электронная конфигурация комплексообразователя
Устойчивость, реакционная способность и многие физические свойства координационных соединений 3d-металлов во многом определяются электронной конфигурацией комплексообразователя, симметрией координационного полиэдра и значениями констант образования, определяющих стандартную величину окислительно-восстановительного потенциала.
Откуда
Для одного и того же комплексообразователя окислительно-восстановительный потенциал может существенно изменяться; этим достигается стабилизация требуемой степени окисления центрального иона. В табл. 9.3 приведены степени окисления 3d-металлов в координационных соединениях.
Электронные конфигурации во многом предопределяют свойства и строение координационных соединений 3d-металлов. 3d0 (Sc3+, Ti4+, V5+, Cr6+, Mn7+) обычно образуют тетраэдрические тетраоксоанионы ( 3d1 (Ti3+, V4+ или VO2+, Cr5+, Mn6+), соединения Ti3+ обычно имеют октаэдрическое строение [TiCl6]3–, [Ti(H2O)6]3+, в водных растворах V4+ не существует, переходя в ванадил-ион с искаженной октаэдрической структурой [VO(H2O)5]2+. Соединения Cr5+ и Mn6+ обычно известны в виде анионов 3d2 (Ti2+, V3+, Cr4+, Mn5+, Fe6+). В водных растворах они неустойчивы: [Ti(H2O)6]2+ – сильнейший восстановитель, 3d3 (V2+, Cr3+, Mn4+). Из них наиболее устойчив Cr3+ в октаэдрических комплексах, которые относятся к инертным соединениям независимо от вида комплекса (катионного, анионного или нейтрального). Они интенсивно окрашены, поскольку основные полосы поглощения находятся в видимой области. 3d4 (Cr2+, Mn3+). В водных растворах гексааквакомплексы [Cr(H2O)6]2+ и [Mn(H2O)6]3+ неустойчивы; первый окисляется до [Cr(H2O)6]3+, а второй диспропорционирует 2Mn3+→ Mn2+ + Mn4+. Стабилизируют эту электронную конфигурацию двойные соли M2ISO4∙CrSO4∙6H2O (M = NH4+, Na+, K+, Rb+, Cs+), в которых Cr2+ остается высокоспиновым (S = 2) и бидентатные лиганды (dipy – дипиридил и phen – фентантролин). Комплексы [Cr(dipy)3]X2 и [Cr(phen)3]X2 (X = Cl, Br, I) оказываются низкоспиновыми (S = 1). В моногидрате ацетата Cr (II) стабилизация электронной конфигурации обусловлена димеризацией (рис. 9.8).
Межатомное расстояние Cr–Cr (0,264 нм) обусловлено образованием четверной связи между атомами хрома за счет всех четырех d-электронов. Соединения Mn (III) стабильны с лигандами, образующими металлоцикл, в частности с ацетилацетоном
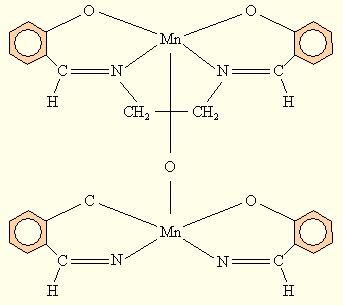
или с тетрадентатными плоскими лигандами типа N'N'-этилен-бис(салицилиденимином), в которых Mn(III) стабилизируется в результате димеризации с образованием μ-оксо соединения – μ-оксо-[N'N'этилен-бис(салицилидениминат) марганца (III)]
3d5 (Mn2+, Fe3+). Октаэдрические комплексы устойчивы как в водных, так и неводных растворах. С лигандами слабого поля они образуют высокоспиновые комплексы – [Fe(H2O)6]Cl3, K3[FeF6], с лигандами сильного поля – низкоспиновые комплексы: K3[Fe(CN)6], K4[Mn(CN)6]. 3d6 (Fe2+, Co3+, реже Ni4+). Электронной конфигурации 3d6 в октаэдрическом окружении энергетически выгодно образование низкоспиновых комплексов (энергия стабилизации кристаллическим полем наибольшая – 2,4 Δокт); только слаболигандные комплексы остаются высокоспиновыми – [FeF6]4– и [CoF6]3–. 3d7 (Co2+, реже Ni3+). Октаэдрические комплексы Co(II) в водных растворах менее стабильны, чем тетраэдрические. Это обусловлено более симметричным размещением электронов на расщепленных полем лигандов d-орбиталях: 3d8 (обычно Ni2+). В многочисленных октаэдрических комплексных ионах – [Ni(H2O)6]2+, [Ni(NH3)6]2+, [Ni(NO2)6]4– – Ni2+ сохраняет два неспаренных электрона. Если же образуются плоские четырехкоординационные (квадратные) комплексы типа [Ni(CN)4]2–, то они не содержат неспаренных электронов (S = 0) из-за того, что понижение симметрии от октаэдрической до квадратной приводит к расщеплению трехкратновырожденного уровня (dε, t2g) на дву- и однократный (синглетный), а двукратновырожденный уровень (dγ, eg) – на два синглета. В результате самый высокоэнергетический синглетный уровень оказывается незаселенным. 3d9 (Cu2+). Ионы Cu2+ образуют многочисленные координационные соединения с координационными числами шесть, пять и четыре: [Cu(H2O)6]2+, [CuCl5]3–, [Cu(NH3)4]2+ или [CuCl4]2–. Единственный неспаренный электрон сохраняется независимо от симметрии. Моногидрат ацетата меди (II) в кристаллическом состоянии изоструктурен моногидрату ацетата хрома (II) (рис. 9.8). В бис(μ-диацетато-0'0'-аква) димеди (II) ионы меди (II) связаны слабой δ-связью, результатом которой является молекулярный антиферромагнетизм, объясненный впервые при интерпретации необычных спектров электронного парамагнитного резонанса. 3d10 (Cu+, Zn2+). Ион Cu+ обычно является двухкоординационным [CuCl2]–, [Cu(NH3)2]+, а Zn2+ в зависимости от лигандов может быть тетраэдрическим [Zn(CN)4]2– или октаэдрическим [Zn(H2O)6]2+. Кинетическая устойчивость комплексов во многом определяется электронной конфигурацией центрального атома и его симметрией. Окраска координационных соединений обусловлена переходами между энергетическими уровнями, определяемыми электронной конфигурацией центрального иона и симметрией координационного полиэдра. При этом поглощается часть видимого спектра в виде суперпозиции полос поглощения как результат перехода с нижнего уровня на вышележащие, а соединение приобретает окраску, дополнительную к цвету поглощаемых лучей (табл 9.2). Ионы [Sc(Lig)6]3+ и [Zn(Lig)6]2+ бесцветны, поскольку у первого нет электронов на dε-уровне, а у второго все d-орбитали заполнены. Окраска тетраэдрических тетраоксоанионов 9.6. Реакции с участием координационных соединений window.top.document.title = "9.6. Реакции с участием координационных соединений"; Реакции с участием координационных соединений делятся на четыре основных типа: 1) присоединение, замещение или отщепление лиганда; 2) изомеризации координационного полиэдра; 3) реакции связанного лиганда; и 4) реакции электронного переноса. 1а. Присоединение лиганда сопровождается изменением степени окисления реагирующих центрального атома и лигандов
или с их сохранением
1б. Замещение лиганда с разрывом связи металл–донорный атом кинетически совпадает с повышением их констант образования. 1в. Отщепление лиганда с разрывом связи сопровождается внутримолекулярным окислительно-восстановительным взаимодействием
2. Изомеризация – весьма распространенное явление среди геометрических и оптических изомеров:
Некоторые оптические изомеры типа
склонны к рацемизации, т. е. к образованию эквимольной смеси право- (d) и лево- (l) вращающих комплексов по следующей схеме:
3. Реакции связанного лиганда многообразны и в некоторых случаях служат основой получения новых органических и неорганических соединений.
При перекристаллизации из R–OH бис-(диэтилдитиокарбоната)Ni (II) легко протекает реакция переэтерификации (Et2NCS2)2Ni + 4R–OH → (R2NCS2)2Ni + 4EtOH. В результате взаимодействия бис(ацетилацетоната)Ni (II) с этилендиамином получается N'N'-этилен-бис(ацетилацетониминат)Ni (II), который при извлечении иона Ni (II) даст органическое соединение N'N'-этилен-бисацетилацетонимин.
4. Реакции электронного переноса сопровождаются изменением степени окисления центрального иона и вызваны образованием более устойчивых электронных конфигураций за счет увеличения энергии стабилизации кристаллическим полем (ЭСКП).
|






 ) и октаэдрические [ScF6]3–, [TiF6]2–, [VF6]–.
) и октаэдрические [ScF6]3–, [TiF6]2–, [VF6]–. и
и  которые в водной среде диспропорционируют.
которые в водной среде диспропорционируют. и
и  – сильнейшие окислители. Они в этих степенях окисления существуют только в твердом состоянии.
– сильнейшие окислители. Они в этих степенях окисления существуют только в твердом состоянии. 1
1
 2
2
 3
3
 4
4

 (
(
 ) в октаэдре и
) в октаэдре и 
 (e4
(e4  ) в тетраэдре. Октаэдрические комплексы Ni3+ получены только в примесных кристаллах, в которых Ni3+ занимает место Al3+.
) в тетраэдре. Октаэдрические комплексы Ni3+ получены только в примесных кристаллах, в которых Ni3+ занимает место Al3+. объясняется переходом электронов со связывающих, заполненных электронами оксо-лигандов, на несвязывающие dγ (dz⊃2;, dx²–y²) центрального атома. По мере увеличения заряда аниона разность между этими уровнями меняется и в
объясняется переходом электронов со связывающих, заполненных электронами оксо-лигандов, на несвязывающие dγ (dz⊃2;, dx²–y²) центрального атома. По мере увеличения заряда аниона разность между этими уровнями меняется и в 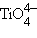 энергия перехода выходит из видимого диапазона.
энергия перехода выходит из видимого диапазона.



 транс-
транс- 
 1
1
 2
2
 3
3
 4
4





