Глава 17.Комплексные соединения
Основные определения
В этой главе вы познакомитесь с особой группой сложных веществ, называемых комплексными (или координационными) соединениями.
| Комплексное соединение– химическое вещество, в состав которого входят комплексные частицы.
|
В настоящее время строгого определения понятия "
комплексная частица" нет. Обычно используется следующее определение.
| Комплексная частица – сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию.
|
Например, гидратированный ион меди [Cu(H
2O)
4]
2 
– комплексная частица, так как она реально существует в растворах и некоторых кристаллогидратах, образована из ионов Cu
2 
и молекул H
2O, молекулы воды – реально существующие молекулы, а ионы Cu
2 
существуют в кристаллах многих соединений меди. Напротив, ион SO
42 
не является комплексной частицей, так как, хоть ионы O
2 
в кристаллах встречаются, ион S
6 
в химических системах не существует.
Примеры других комплексных частиц: [Zn(OH)4]2  , [Al(H2O)6]3
, [Al(H2O)6]3  , [Cu(H2O)2Br2], [HgI4]2
, [Cu(H2O)2Br2], [HgI4]2  .
.
Вместе с тем к комплексным частицам относят ионы NH4  и H3O
и H3O  , хотя ионы H
, хотя ионы H  в химических системах не существуют.
в химических системах не существуют.
Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму. В большинстве комплексных частиц так и есть, но, например, в алюмокалиевых квасцах [K(H2O)6][Al(H2O)6]SO4 в комплексной частице [Al(H2O)6]3  связь между атомами Al и O действительно образована по донорно-акцепторному механизму, а в комплексной частице [K(H2O)6]
связь между атомами Al и O действительно образована по донорно-акцепторному механизму, а в комплексной частице [K(H2O)6]  имеется лишь электростатическое (ион-дипольное) взаимодействие. Подтверждение этого – существование в железоаммонийных квасцах аналогичной по строению комплексной частицы [NH4(H2O)6]
имеется лишь электростатическое (ион-дипольное) взаимодействие. Подтверждение этого – существование в железоаммонийных квасцах аналогичной по строению комплексной частицы [NH4(H2O)6]  , в которой между молекулами воды и ионом NH4
, в которой между молекулами воды и ионом NH4  возможно только ион-дипольное взаимодействие.
возможно только ион-дипольное взаимодействие.
По заряду комплексные частицы могут быть катионами, анионами, а также нейтральными молекулами. Комплексные соединения, включающие такие частицы, могут относиться к различным классам химических веществ (кислотам, основаниям, солям). Примеры: (H3O)[AuCl4] – кислота, [Ag(NH3)2]OH – основание, NH4Cl и K3[Fe(CN)6] – соли.
| Комплексообразователь– центральный атом комплексной частицы.
|
Обычно комплексообразователь – атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Степень окисления комплексообразователя может быть положительной, отрицательной или равной нулю; при образовании комплексного соединения из более простых веществ она не меняется.
| Лиганды– атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя.
|
Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H
2O, CO, NH
3 и др.), анионы (OH

, Cl

, PO
43 
и др.), а также катион водорода. Различают
унидентатные или монодентатные лиганды (связанные с центральным атомом через один из своих атомов, то есть, одной

-связью),
бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя

-связями),
тридентатные и т. д.
Координационное число (КЧ) – число  -связей, образуемых центральным атомом с лигандами. -связей, образуемых центральным атомом с лигандами.
|
Если лиганды унидентатные, то координационное число равно числу таких лигандов.
КЧ зависит от электронного строения центрального атома, от его степени окисления, размеров центрального атома и лигандов, условий образования комплексного соединения, температуры и других факторов. КЧ может принимать значения от 2 до 12. Чаще всего оно равно шести, несколько реже – четырем.
Существуют комплексные частицы и с несколькими центральными атомами.
| Внутренняя сфера комплексного соединения – центральный атом со связанными с ним лигандами, то есть, собственно комплексная частица. Внешняя сфера комплексного соединения – остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
|
Используются два вида структурных формул комплексных частиц: с указанием формального заряда центрального атома и лигандов, или с указанием формального заряда всей комплексной частицы. Примеры:
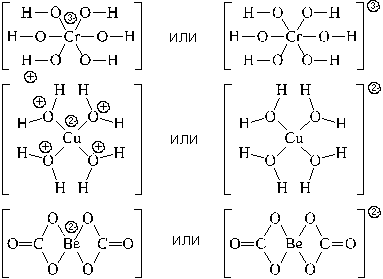
Для характеристики формы комплексной частицы используется представление о координационном полиэдре (многограннике).
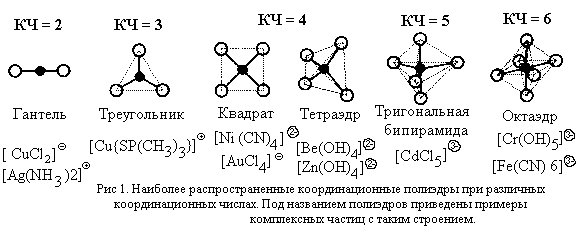
| Координационный полиэдр – воображаемый многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах – атомы лигандов, непосредственно связанные с комплексообразователем.
|
К координационным полиэдрам относят также квадрат (КЧ = 4), треугольник (КЧ = 3) и гантель (КЧ = 2), хотя эти фигуры и не являются многогранниками. Примеры координационных полиэдров и имеющих соответствующую форму комплексных частиц для наиболее распространенных значений КЧ приведены на рис. 1.
 – комплексная частица, так как она реально существует в растворах и некоторых кристаллогидратах, образована из ионов Cu2
– комплексная частица, так как она реально существует в растворах и некоторых кристаллогидратах, образована из ионов Cu2  и молекул H2O, молекулы воды – реально существующие молекулы, а ионы Cu2
и молекул H2O, молекулы воды – реально существующие молекулы, а ионы Cu2  существуют в кристаллах многих соединений меди. Напротив, ион SO42
существуют в кристаллах многих соединений меди. Напротив, ион SO42  не является комплексной частицей, так как, хоть ионы O2
не является комплексной частицей, так как, хоть ионы O2  в кристаллах встречаются, ион S6
в кристаллах встречаются, ион S6  в химических системах не существует.
в химических системах не существует.
 , Cl
, Cl  , PO43
, PO43  и др.), а также катион водорода. Различают унидентатные или монодентатные лиганды (связанные с центральным атомом через один из своих атомов, то есть, одной
и др.), а также катион водорода. Различают унидентатные или монодентатные лиганды (связанные с центральным атомом через один из своих атомов, то есть, одной  -связью), бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя
-связью), бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя  -связями), тридентатные и т. д.
-связями), тридентатные и т. д.






